Terug naar het richtlijnenoverzicht
Deze richtlijn dient ter vervanging van de in 2018 verschenen NFN richtlijn ‘Peritoneale dialyse effectiviteit en monitoring membraanfunctie bij PD’. De ISPD heeft recent over deze twee onderwerpen twee aparte guidelines uitgebracht:
Deze 2 onderwerpen zullen in 2 aparte NFN richtlijnen besproken worden.
In deze richtlijn zal het onderwerp ‘Evaluatie van de peritoneale membraanfunctie’ besproken worden. De voornaamste aanbevelingen van de ISPD zijn in deze NFN richtlijn vertaald naar praktische adviezen. Voor meer achtergrondinformatie verwijzen wij naar de ISPD guideline.
De ISPD geeft adviezen weer met een level of evidence volgens het GRADE systeem:
Daarbij wordt een mate van ‘certainty’ gegeven;
Adviezen met een lage certainty evidence (2C of 2D) worden beschreven als ‘Practice points’.
Belangrijkste wijzigingen t.o.v. de vorige richtlijn ‘Peritoneale dialyse effectiviteit en monitoring membraanfunctie bij PD’
In deze richtlijn is de nadruk gelegd op de evaluatie van de peritoneale membraanfunctie en de praktische consequenties hiervan in de klinische praktijk, zoals in overzicht weergegeven in figuur 1. Hiermee wordt er met het bepalen van de D/Pkreatinine, de ultrafiltratie capaciteit en de natrium sieving/dip dieper ingegaan op de evaluatie van de peritoneale membraanfunctie dan in de vorige richtlijn het geval was.
Daarnaast zijn er enkele verschillen in aanbevelingen tussen deze en de vorige richtlijn:
Auteurs
Drs. T. IJzermans, Ties.ijzermans@radboudumc.nl
Dr. A.C. Abrahams, A.C.Abrahams@umcutrecht.nl
Dr. C.W.H. de Fijter, C.W.H.deFijter@olvg.nl
Dr. A.L.H.J. Aarnoudse, albert-jan.aarnoudse@catharinaziekenhuis.nl
Verantwoordelijk lid van de Richtlijnencommissie NFN:
Dr. A.L.H.J. Aarnoudse, albert-jan.aarnoudse@catharinaziekenhuis.nl
Geen belangenverstrengeling.
Hoofdstuk 1. Redenen om peritoneale membraanfunctie te meten
Hoofdstuk 2. Wanneer dient de peritoneale membraanfunctie gemeten te worden
Hoofdstuk 3. Hoe wordt de peritoneale membraanfunctie gemeten
Hoofstuk 4. Interpretatie van de resultaten van de peritoneale membraanfunctiemetingen
Netto UF volume
Dialysaat-plasma ratio kreatinine
Natrium sieving/dip
Hoofdstuk 5. Klinische implicaties
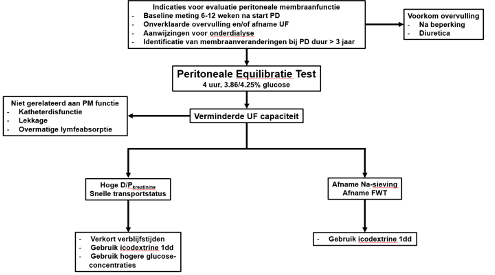
Figuur 1. Overzicht van de adviezen in deze richtlijn.
Afkortingen; PD = peritoneale dialyse, UF = ultrafiltratie, Na = natrium, PM = peritoneale membraan, D/P dialysaat : plasma, FWT = vrije waterklaring.
Onderbouwing
Peritoneale membraanfunctie wordt gedefinieerd als de capaciteit van de peritoneale membraan tot transport van kleine deeltjes en ultrafiltratie (UF) ten behoeve van peritoneale dialyse (PD).
De capaciteit van de peritoneale membraan om kleine deeltjes te transporteren wordt berekend door de dialysaat-plasma ratio van kreatinine (D/Pkreatinine) te berekenen. Uit cohortstudies is gebleken dat de gemiddelde D/Pkreatinine varieert van 0,62-0,73 [3-8]. Als de D/Pkreatinine groter is dan het gemiddelde van de populatie is er sprake van snel peritoneaal transport. De richtlijncommissie adviseert om hiervoor als afkappunt 0,65 te gebruiken. Uit de grootste cohortstudie naar D/Pkreatinine bleek dat een D/Pkreatinine > 0,65 geassocieerd was met negatieve uitkomsten en dus klinisch relevant [8]. Als de D/Pkreatinine kleiner is dan het gemiddelde van 0,65 is er geen sprake van snel peritoneaal transport. In de ISPD guideline wordt overigens niet meer gesproken over langzaam peritoneaal transport.
De UF capaciteit wordt bepaald door de netto UF gedurende een 4-uurs peritoneale equilibriatie test (PET). Dit UF volume hoort > 400 ml te zijn bij gebruik van PD vloeistof die 3,86% of 4,25% glucose bevat [6, 9, 10]. Deze oplossingen bevatten respectievelijk 214 en 236 mmol/L glucose.
Het vrije watertransport (FWT) over de peritoneale membraan tenslotte kan indirect bepaald worden door de natrium sieving/dip te berekenen. Natrium sieving/dip is de daling in de concentratie van natrium in het dialysaat na 1 uur die optreedt doordat er deeltjesvrij watertransport plaatsvindt over de aquaporine-1 kanalen van de peritoneale membraan.
Het meten van de peritoneale membraanfunctie is om een aantal redenen van belang.
Ten eerste kan door het meten van de peritoneale membraanfunctie de behandeling met PD geïndividualiseerd en daarmee geoptimaliseerd worden. Zo kan de peritoneale transportsnelheid meegenomen worden in de keuze voor continue ambulante peritoneale dialyse (CAPD) of automatische peritoneale dialyse (APD). Ook kan er op basis van de peritoneale membraanfunctie gekozen worden voor icodextrine, in plaats van het ophogen van de glucoseconcentratie (zie ook hoofdstuk 5 ‘Klinische implicaties van de PET’).
Ten tweede is snel peritoneaal transport geassocieerd met negatieve uitkomsten.
Snel peritoneaal transport is geassocieerd met een verhoogd risico op mortaliteit (RR 1,15) en een toename van het aantal ziekenhuisopnames (HR 1,05, voor elke 0,1 hogere D/P kreatinine) [4, 11-13]. Het belangrijkste mechanisme hiervoor lijkt een verminderde UF capaciteit en een toename van vochtreabsorptie met als resultaat een positieve vochtbalans [14, 15].
Snel peritoneaal transport is mogelijk ook geassocieerd met een verhoogd risico op PD techniekfalen (RR 1,18) [12].
Tenslotte kan een verandering in de peritoneale membraanfunctie een inschatting geven van de veranderingen die optreden in de peritoneale membraan ten gevolge van de behandeling met PD. Hiermee kan onder andere een inschatting worden gemaakt van het risico op encapsulerende peritoneale sclerose (EPS).
Bovenstaande punten zullen in de rest van de richtlijn verder besproken worden.
Onderbouwing
De richtlijncommissie adviseert om de peritoneale membraanfunctie te meten 6 tot 12 weken na start van de behandeling met PD. De reden hiervoor is dat in de eerste weken na start van de behandeling met PD nog veel veranderingen optreden in de peritoneale membraan(functie) waardoor een meting binnen 6 weken na start PD niet betrouwbaar is. [5, 16, 17] Een te vroege meting van de peritoneale membraanfunctie geeft een overschatting van het aantal patiënten met een snelle peritoneale transportstatus.
Daarnaast adviseert de richtlijncommissie thans om de peritoneale membraanfunctie alleen op indicatie te meten. Dit is conform de ISPD guideline. Hiermee wordt het advies, dat in de vorige richtlijn ‘Peritoneale dialyse effectiviteit en monitoring membraanfunctie bij PD’ uit 2018 stond, om dit jaarlijks te herhalen verlaten. Er zijn namelijk geen studies die aantonen dat dit meerwaarde heeft ten opzichte van het meten op indicatie. Daarbij heeft de uitslag van een PET in de eerste jaren meestal geen klinische consequenties als er geen klinisch probleem is. Tenslotte zijn kosten en een tekort aan verpleegkundigen redenen om niet standaard een PET te adviseren.
Het staat centra echter vrij om de peritoneale membraanfunctie routinematig (bijvoorbeeld jaarlijks) te meten als hier op basis van individuele kenmerken van het centrum reden toe zijn. Zo kan het routinematig uitvoeren van de PET overwogen worden om de ervaring bij dokters en verpleegkundigen te behouden of om het verloop van de peritoneale membraanfunctie te vervolgen en het peritoneale dialyse voorschrift te optimaliseren. Ook wordt de jaarlijkse PET door verscheidene centra als evaluatiemoment gebruikt.
Indicaties voor het evalueren van de peritoneale membraanfunctie staan vermeld in figuur 1.
Het gaat hierbij met name om klinische situaties, zoals onverklaarde overvulling al dan niet in combinatie met een afname in het UF volume of aanwijzingen voor onderdialyse (klinisch of biochemisch). In zulke situaties kan evaluatie van de peritoneale membraanfunctie informatie geven hoe het PD voorschrift het beste aangepast kan worden.
De richtlijncommissie adviseert verder om na langdurige behandeling met PD (> 3 jaar) te overwegen de peritoneale membraanfunctie jaarlijks te meten om een inschatting te kunnen maken van de veranderingen die zijn opgetreden in de peritoneale membraan. Langdurige blootstelling aan PD vloeistoffen kan inflammatie en progressieve schade aan de peritoneale membraan veroorzaken. Hierbij treden veranderingen op (i.e. fibrose, neoangiogenese en vasculopathie), die geassocieerd zijn met het ontstaan van een verminderde UF capaciteit, snel peritoneaal transport, afname van vrij watertransport (free water transport, FWT), en een risico op EPS. [18-23]
Onderbouwing
De richtlijncommissie adviseert om de peritoneale membraanfunctie te meten met een standaard 4-uurs peritoneale equilibratie test. (PET)[3] Alternatieve methodes om de PET uit te voeren zijn mogelijk, maar zijn arbeids- en tijdsintensief en dit wordt daarom niet aangeraden voor de klinische praktijk. Zie bijlage 1 voor een uitgebreide beschrijving van de uitvoering van de standaard 4-uurs PET, inclusief de berekening van de natrium sieving/dip.
De richtlijncommissie adviseert om de PET uit te voeren met PD vloeistof die 3,86% of 4,25% glucose bevat, met name omdat hiermee de natrium sieving/dip kan worden berekend zoals wordt geadviseerd in deze richtlijn. Ook kan met PD vloeistof die glucose 3,86% of 4,25% bevat de maximale UF capaciteit bepaald worden. Als alternatief kan ook gekozen worden voor PD vloeistof die 2,27% of 2,3% glucose bevat. Er kan dan echter geen natrium sieving/dip en/of maximale UF capaciteit worden berekend. Ook is er voor die vloeistoffen geen afkapwaarde bekend voor een verminderde UF capaciteit.
Om de PET zoveel mogelijk te standaardiseren wordt geadviseerd om 2 liter PD vloeistof in te laten lopen. Op individuele basis kan ervoor worden gekozen om de PET met een kleiner volume van 1,5 liter te verrichten, zoals bij patiënten die een groter volume niet verdragen.
Na 4 uur dient het netto UF volume te worden gemeten. Dit is het verschil tussen het uitloopvolume na 4 uur en het inloopvolume en is een maat voor de UF capaciteit van de peritoneale membraan.
Na 4 uur dient ook de concentratie kreatinine in het dialysaat te worden gemeten en te worden gedeeld door de plasmaconcentratie kreatinine (i.e. D/Pkreatinine). Deze ratio is een maat voor de snelheid van deeltjes transport over de peritoneale membraan. Hiermee kan worden bepaald of er bij een patiënt sprake is van een snelle peritoneale transportstatus of dat dit niet het geval is.
De richtlijncommissie acht, conform de vorige richtlijn, dat er onvoldoende bewijs is voor additionele testen van de peritoneale membraanfunctie om deze aan te kunnen bevelen voor de klinische praktijk. Het meten van CA-125 in het dialysaat is het uitgebreidst beschreven waarbij een dalend CA-125 in het dialysaat geassocieerd is met techniekfalen en met een verhoogd risico op EPS. [24, 25] Over de waarde van het meten van CA-125 is echter veel discussie. [26] Dit komt met name doordat er ook andere situaties zijn waardoor CA-125 kan dalen en het CA-125 kan juist ook stijgen bij schade aan de peritoneale membraan. [25-27]
De ISPD guideline bespreekt nog enkele andere methodes om de peritoneale membraanfunctie te meten, zoals het meten van eiwitverlies, intraperitoneale druk of lymfeabsorptie. Echter omdat bewijs voor invloed op therapiesucces of overleving ontbreekt raadt zij het gebruik hiervan voor de klinische praktijk af en laten we deze buiten de beschouwing van deze richtlijn.
Netto UF volume
Dialysaat-plasma ratio kreatinine
Natrium sieving/dip
Onderbouwing
Bij de interpretatie van de PET zijn de volgende drie uitkomsten van belang;
Netto UF volume als maat voor UF capaciteit
Er is sprake van een verminderde UF capaciteit van de peritoneale membraan als het netto UF volume < 400 ml bedraagt bij gebruik van PD vloeistof die 3,86% of 4,25% glucose bevat. [6, 9, 10]
Deze definitie kan worden onthouden met de 3 x 4 regel: minder dan 400 ml netto UF na een verblijfsduur van 4 uur in de buikholte met een PD vloeistof die 4% (3,86% of 4,25%) glucose bevat.
Het is belangrijk om andere oorzaken die niet gerelateerd zijn aan de peritoneale membraanfunctie uit te sluiten zoals uitloopproblemen door disfunctie van de PD katheter, lekkage van PD vloeistof naar de pleuraholte of subcutaan, of overmatige lymfeabsorptie van PD vloeistof (zie figuur 1).
Een verminderde UF capaciteit wordt veroorzaakt door een snelle transportstatus en/of een afname van het vrij watertransport (FWT).
D/Pkreatinine als maat voor snelheid van peritoneaal transport van kleine deeltjes
Bij een D/Pkreatinine > 0,65 is er sprake van snel peritoneaal transport. De ISPD guideline maakt geen onderscheid tussen groepen bij een D/Pkreatinine ≤ 0,65 en classificeert deze in wezen als ‘niet snel peritoneaal transport’.
Snel peritoneaal transport kan direct bij de start van de behandeling met PD aanwezig zijn, of kan ontstaan gedurende de behandeling met PD. De snelheid van het peritoneaal transport neemt toe gedurende de lange termijn behandeling wat wordt verklaard door expositie aan glucose, glucose afbraakproducten, peritonitis en verlies aan restnierfunctie. [5, 28-32] Dit laatste vermoedelijk doordat er dan meer noodzaak is tot het gebruik van vloeistoffen met hogere glucoseconcentraties. Deze toename in de snelheid van het transport over de tijd wordt met name gezien bij het gebruik van conventionele dialysevloeistoffen. [33, 34]
Zoals beschreven in hoofdstuk 1 is snel peritoneaal transport geassocieerd met een verhoogd risico op mortaliteit, ziekenhuisopname en PD techniekfalen.
Natrium sieving/dip als maat voor het vrij watertransport
Met natrium sieving/dip wordt daling van de natrium concentratie in de PD vloeistof gedurende het eerst uur van de PD behandeling bedoeld. De natrium sieving/dip wordt weergegeven als de absolute daling in de natrium concentratie in het dialysaat vanaf baseline; [Na+]t=0 – [Na+]t=60 met t in minuten. Deze kan ook worden weergegeven in een ratio 1 – [Na+]t=60 / [Na+]t=0. De normaalwaarde van de natrium sieving/dip is 9 mmol/L (IQR 6-11 mmol/L)[35]. Een normale natrium sieving/dip ratio is 0.07 (IQR 0.055 – 0.085).
Natrium sieving/dip is een indirecte maat voor het FWT. [36-39] Het wordt ten dele beïnvloed door de transportsnelheid van de peritoneale membraan en geeft additionele informatie over het watertransport over de peritoneale membraan. Bij een afgenomen natrium sieving/dip is er sprake van een verminderd FWT. Oorzaken voor een afname in het FWT zijn progressieve peritoneale fibrose en vasculopathie. [40, 41]
Bij de interpretatie van de natrium sieving/dip is het van belang dat de uitkomst niet als een absolute waarde moet worden gezien. Er zijn dan ook geen afkapwaarden bekend. In plaats daarvan moet de afname van de natrium sieving/dip in de tijd beoordeeld worden per individu. Een progressieve daling van de natrium sieving/dip over de jaren heen lijkt een betere voorspeller van een verminderde UF capaciteit dan veranderingen in snelheid van peritoneaal transport. [42] Daarbij geeft een daling van de natrium sieving/dip informatie over toenemende peritoneale interstitiële fibrose wat kan leiden tot een verminderde UF capaciteit. [5, 29, 41, 43] Door de natrium sieving/dip per patiënt te vervolgen kan een inschatting worden gemaakt van het verlies aan FWT en daarmee het risico op een verminderde UF capaciteit.
Onderbouwing
Op basis van de uitslagen van de PET kan een aantal acties ondernomen worden (zie figuur 1).
Ten eerste is het belangrijk om vast te stellen of er sprake is van verminderde UF capaciteit (zie hoofdstuk 3/4). Het is hierbij belangrijk om andere oorzaken van een verminderd netto UF volume dan een verminderde UF capaciteit uit te sluiten (zie figuur 1). Bij een verminderde UF capaciteit is er een verhoogd risico op overvulling wat geassocieerd is met slechte uitkomsten. Dit is met name relevant bij patiënten met weinig tot geen restfunctie die niet (meer) kunnen compenseren.
Bij een verminderde UF capaciteit in combinatie met tekenen van overvulling dienen patiënten een natrium- en vochtbeperking te krijgen en de dosering diuretica dient zo mogelijk opgehoogd te worden. Daarbij is het belangrijk om te overwegen het PD voorschrift aan te passen. Een verminderde UF capaciteit kan veroorzaakt worden door snel peritoneaal transport of door verminderd FWT, het is daarom belangrijk op basis van deze uitslagen het PD voorschrift aan te passen.
Klinische implicaties van een snelle peritoneale transportstatus
Bij patiënten met een snelle peritoneale transportstatus is er sprake van sneller verlies van de glucose gradiënt en daarmee van een verminderde netto UF. [14] Daarbij is er bij deze patiënten een verhoogd risico op reabsorptie van vocht vanuit de buikholte terug naar de bloedbaan omdat de osmotische gradiënt versneld verloren gaat. [15] Er dient daarom bij patiënten met een snelle transportstatus een kortere verblijfsduur van PD vloeistof te worden toegepast. Dit kan onder andere bereikt worden met APD. Enkele observationele studies laten zien dat bij patiënten met een snel peritoneaal transport APD geassocieerd was met een lagere mortaliteit dan CAPD. [8, 12, 44] Hoewel de mortaliteit in de APD groep lager was t.o.v. de CAPD groep bij een snelle transportstatus bleef de mortaliteit in de groep met een snelle peritoneale transportstatus in deze studies echter ook bij APD hoger dan bij patiënten zonder een snelle peritoneale transportstatus.
Bij patiënten met een D/Pkreatinine < 0,5 zijn er aanwijzingen dat CAPD beter is dan APD, met name bij een lege buik overdag bij APD [44]. Door de kortere verblijfsduur van PD vloeistof bij een behandeling met APD kan er onvoldoende klaring plaatsvinden van kleine deeltjes. De langere verblijfsduur overdag kan hiervoor maar ten dele compenseren.
Hoewel op theoretische gronden de snelheid van het peritoneale transport bepalend kan zijn voor de keuze voor CAPD of APD wordt deze keuze in de praktijk vooral door andere factoren bepaald, zoals de voorkeur en levensstijl van patiënt en de technische haalbaarheid. Het is met name belangrijk om vochtreabsorptie te voorkomen; dit risico is verhoogd bij een snelle peritoneale transportstatus.
Bij een snelle peritoneale transportstatus dient ook overwogen worden om 1x keer per dag een wisseling met lange verblijfsduur te doen met icodextrine.
Icodextrine is PD vloeistof die glucosepolymeren bevat. Icodextrine wordt slechts langzaam via lymfebanen opgenomen (en niet door de peritoneale membraan) en blijft daardoor langdurig intraperitoneaal oncotisch actief. [45, 46] Dit resulteert in een langdurige, geleidelijke UF. Icodextrine verbetert de UF capaciteit en kan zo bijdragen aan een betere volumestatus. [47, 48] Daarnaast is van icodextrine aangetoond dat het bij een lange verblijfsduur vochtreabsorptie voorkomt. [49] Deze effecten zijn met name bewezen bij patiënten met een snelle peritoneale transportstatus. In een Cochrane review en een recente systematic review en meta-analyse werden gunstige effecten van icodextrine beschreven op UF capaciteit en op het voorkomen van overvulling. [50-52] Er werd in deze studies echter geen verbetering in PD techniek overleving gezien en slechts een klein effect op mortaliteit.
Tenslotte kan een PD vloeistof die een hogere glucoseconcentratie bevat gebruikt worden. Hoge glucoseconcentraties leiden echter sneller tot meer schade aan de peritoneale membraan. [29, 30, 43] Derhalve adviseert de richtlijncommissie dit als laatste maatregel toe te passen.
Klinische implicaties van een verminderd FWT
Indien er sprake is van een verminderde UF capaciteit door een verminderd FWT dient overwogen te worden om 1x per dag een wisseling te doen met icodextrine om overvulling te behandelen en/of te voorkomen. Van icodextrine is immers aangetoond dat het leidt tot watertransport via de kleine poriën en niet via de aquaporine-1 kanalen. [53, 54] Belangrijk is wel om op te merken dat dit een theoretische overweging is, omdat onderbouwing door literatuur ontbreekt.
Daarnaast lijkt een progressieve daling van de natrium sieving/dip een voorspeller te zijn voor het risico op EPS. EPS ontstaat zelden binnen 3 jaar na de start van behandeling met PD. [55-59] In de ISPD richtlijn aangaande EPS wordt dan ook geadviseerd om pas na 3 jaar behandeling met PD een risico inschatting te maken van het risico op EPS [60]. Het meten van de natrium sieving/dip kan hierbij helpen waarbij er bij een natrium sieving/dip van ≤ 5 mmol/L of een natrium sieving/dip ratio < 0,03 geassocieerd is met een verhoogd risico op EPS. [37, 41, 61, 62]
Opgemerkt dient te worden dat de incidentie van EPS in Nederland inmiddels zeer laag is (incidentie van 0.14% in 2014) zoals aangetoond door de Nederlandse EPS registratie. [63] Sindsdien zijn er 3 nieuwe casus gemeld bij de Nederlandse EPS registratie. Daarnaast is het risico op overlijden door andere aandoeningen bij oudere PD patiënten veel groter dan het risico op overlijden aan EPS. [64] Derhalve dient de keuze om de peritoneale membraanfunctie jaarlijks te meten na 3 jaar behandeling met PD op individuele basis gemaakt te worden, rekening houdend met de leeftijd, de mogelijkheid om te wisselen naar een andere dialysemodaliteit en de verwachte resterende tijd aan PD. Het is daarbij van belang de patiënt te betrekken bij te maken keuzes aangaande een verhoogd risico op EPS.
In deze bijlage wordt de uitvoering van de PET beschreven waarmee het netto UF volume en de D/Pkreatininebepaald kunnen worden. Daarnaast kan met een extra monster van het dialysaat na 1 uur de natrium sieving/dip gemeten worden. Voor het meten van de natrium sieving/dip en de maximale UF capaciteit is het noodzakelijk om PD vloeistof die 3,86% of 4,25% glucose bevat te gebruiken.
Er kan overwogen worden om tijdens de PET na 2 uur een extra dialysaat monster af te nemen voor interne validatie. De richtlijncommissie adviseert niet om dit standaard te doen omdat de PET hierdoor meer arbeidsintensief wordt en omdat een monster na 4 uur bij gestandaardiseerde uitvoering alle informatie geeft die nodig is voor de klinische praktijk.
Zie figuur 1 voor indicaties om een PET uit te voeren.
Het is belangrijk om geen PET uit te voeren als er sprake is van:
Bij aanvang van de PET moet er gedurende tenminste 3 uur PD vloeistof intraperitoneaal aanwezig zijn. Een PET kan dus niet worden uitgevoerd met vooraf een lege buik. Bij patiënten die met APD worden behandeld zonder laatste inloop, en die dus overdag een lege buik hebben, moet er voorafgaand aan de PET een inloop worden gedaan met PD vloeistof met een verblijfsduur van tenminste 3 uur. Er wordt geadviseerd om geen icodextrine te gebruiken voorafgaand aan de PET omdat dit de uitkomst van de D/Pkreatinine kan beïnvloeden. [65]
Het is belangrijk de PET zoveel mogelijk gestandaardiseerd en secuur uit te voeren zodat longitudinale vergelijking over meerdere jaren binnen één patiënt mogelijk is.
Stapsgewijze beschrijving van de uitvoering van de PET:
Zie voor het berekenen en interpreteren van de D/Pkreatinine en de natrium sieving/dip hoofdstuk 3 en 4 van deze richtlijn.
© 2022. Alle rechten voorbehouden