NFN richtlijn glomerulonefritis: algemene principes behandeling
Autorisatiedatum: 01-01-2023
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
Gebaseerd op hoofdstuk 1 “general principles for the management of glomerular diseases” van KDIGO glomerular diseases uit 20211
Nederlandse NFN richtlijn is als volgt opgebouwd:
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van een goede zorg voor de patiënt, van een richtlijn moet worden afgeweken.
Auteurs
Dr. H.W. (Henk) van Hamersvelt
Henk.vanhamersvelt@radboudumc.nl
Verantwoordelijk lid van de Richtlijnencommissie NFN
Dr. H.W. (Henk) van Hamersvelt
Henk.vanhamersvelt@radboudumc.nl
Geen belangenverstrengeling
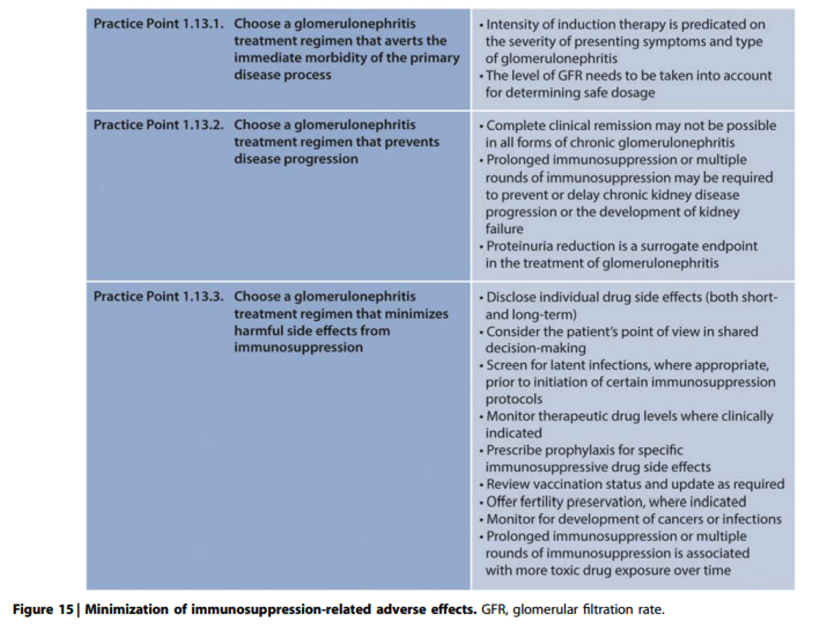
In dit hoofdstuk worden algemene principes voor diagnostische en therapeutische benadering van glomerulaire ziekten besproken, waarbij eventuele afwijkingen van dit beleid bij de verschillende specifieke glomerulaire ziekten verder toegelicht worden. Door grotendeels ontbreken van gerandomiseerde onderzoeken is het meeste bewijs gebaseerd op expert opinion en derhalve ondergebracht in practice points.
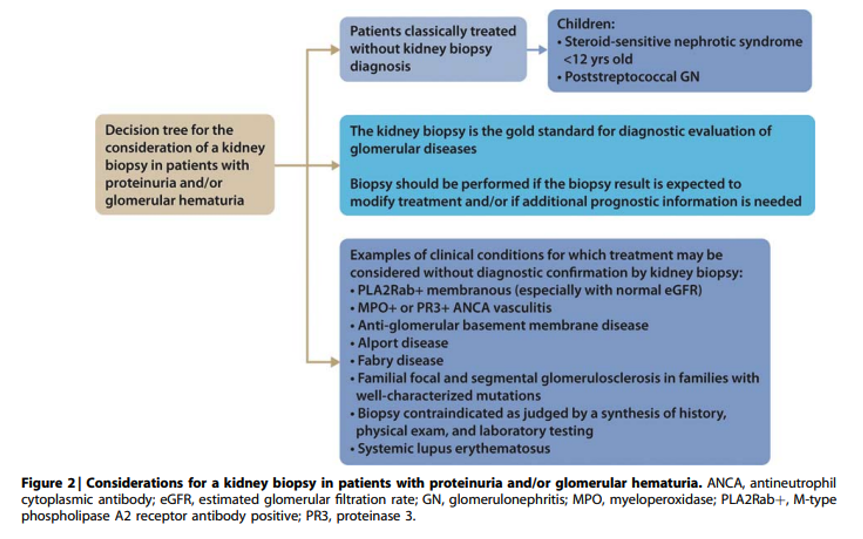
Practice Point 1.1: The kidney biopsy is the “gold standard” for the diagnostic evaluation of glomerular diseases. However, under some circumstances, treatment may proceed without a kidney biopsy confirmation of diagnosis (Figure 2).
Onderbouwing
Bij iedere patiënt zal risico van biopsie afgewogen moeten worden tegen mogelijke voordelen, waarbij uiteraard ook wensen van patiënt een belangrijke rol zullen spelen. Naast bevestiging van diagnose geeft nierbiopsie ook informatie over activiteit van de ziekte, ernst van chronische schade en mogelijk onverwachte bevindingen zoals andere glomerulaire afwijkingen, TMA of TIN die prognostische of zelfs therapeutische waarde kunnen hebben.
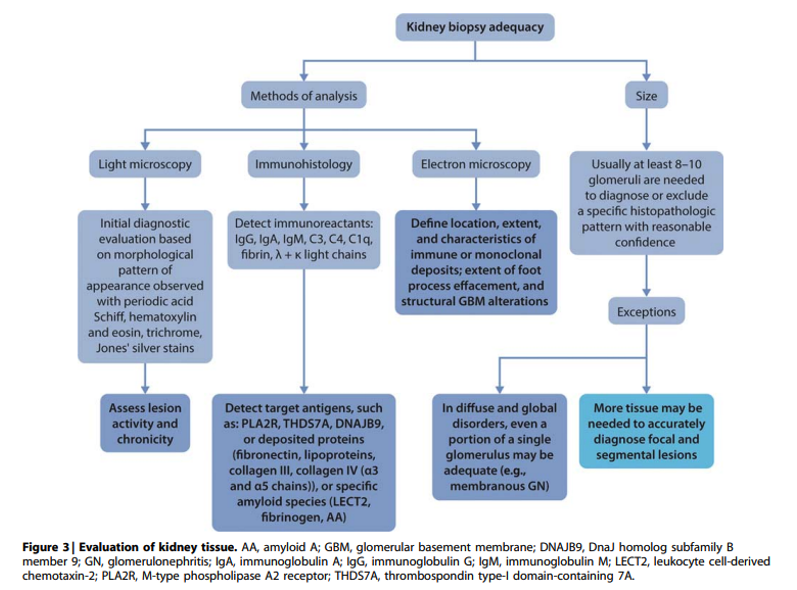
Practice Point 1.2: The evaluation of kidney tissue should meet standards of biopsy adequacy (Figure 3).
Commentaar
In de Nederlandse setting met voldoende (technische en financiële) middelen dienen alle nierbiopten (mede) door ervaren nefropatholoog beoordeeld te worden met lichtmicroscopie, immuunfluorescentie en electronenmicroscopie om de kans van adequate diagnose en bijbehorende behandeling te optimaliseren. Electronenmicroscopie is daarbij een onmisbaar onderdeel voor een aantal diagnoses zoals minimal change disease en immunotactoid deposition disease en kan belangrijke aanvullende informatie geven over de aard van glomerulaire deposities zoals humps bij infectiegerelateerde glomerulonefritis. Waar mogelijk dienen bij de beoordeling door de nefropatholoog internationale scoringssystemen voor uitgebreidheid van chronische en actieve lesies gebruikt te worden zoals MEST-C classificatie voor IgA nefropathie en de ISN/RPS stadia bij lupus nefritis
Aanvullend practice point
Gezien de grote consequenties van onjuiste of incomplete diagnose voor de vaak intensieve en risicovolle behandeling dienen nefrologische centra met laag volume aan nierbiopten en/of ontbreken van mogelijkheden voor electronenmicroscopie hiervoor een samenwerkingsverband aan te gaan met een groter (meestal academisch) centrum met voldoende expertise.
Practice Point 1.3: Repeat kidney biopsy should be performed if the information will potentially alter the therapeutic plan or contribute to the estimation of prognosis
Onderbouwing
Herhaling van nierbiopsie kan noodzakelijk zijn als initiële biopsie inadequaat is voor goede diagnose en kan overwogen worden in onderstaande gevallen:
A. Meting van proteïnurie
Practice Point 1.2.1: Obtain 24-hour urine collection to determine total protein excretion in patients with glomerular disease for whom initiation or intensification of immunosuppression is necessary, or who have a change in clinical status.
Practice Point 1.2.2: For pediatrics, 24-hour urine collection is not ideal as it may not be accurate and is cumbersome to collect. Instead, monitor first morning protein– creatinine ratio (PCR).
Practice Point 1.2.3: Random “spot” urine collections for PCR are not ideal as there is variation over time in both protein and creatinine excretion.
Practice Point 1.2.4: First morning urine collections may underestimate 24-hour protein excretion in orthostatic proteinuria.
Practice Point 1.2.5: When feasible, a reasonable compromise is to collect an “intended” 24-hour urine sample and measure PCR in an aliquot of the collection.
Practice Point 1.2.6: There is no need to simultaneously and routinely quantify sodium excretion on each timed urinary collection, unless there is reason to suspect a failure to adhere to suggestions regarding dietary sodium restriction (Figure 5 and Practice Points 1.4.2 and 1.5.9).
Practice Point 1.2.7: Quantify proteinuria in glomerular disease, as it has disease-specific relevance for prognosis and treatment decision-making. Qualitative assessment of proteinuria may be useful in selected instances.
Practice Point 1.2.8: In children, quantify proteinuria, but goals of treatment should not be different between disease etiologies. A PCR of <200 mg/g (<20 mg/mmol) or <8 mg/m2/hour in a 24-hour urine should be the goal for any child with glomerular disease. Acceptance of a baseline higher than this should come only with kidney biopsy evidence of kidney scarring
Onderbouwing
In verband met variatie in proteïnurie als gevolg van circadiaan ritme, fysieke activiteit en houding (orthostatische proteïnurie) is het bij volwassenen zinvol om voorafgaand aan belangrijke therapeutische beslissingen een 24-uurs urineverzameling te verrichten voor nauwkeurige bepaling van mate van proteïnurie. Als alternatief kan patiënt zelf een monster afnemen uit een 24-uurs urineverzameling. Proteïnurie in eerste ochtendurine onderschat mate van proteïnurie met circa 20% door liggende houding ’s nachts.
Bij kinderen dient bij voorkeur mate van proteïnurie bepaald te worden in eerste ochtendurine.
Voor follow-up van proteïnurie kan wel gebruikt gemaakt worden van eiwit/kreatinine ratio, die bij voorkeur steeds onder zelfde omstandigheden afgenomen dient te worden (zelfde moment van de dag).
Er is bij glomerulaire ziektes met uitzondering van diabetische nefropathie in het algemeen geen indicatie voor meting van albuminurie.
Bij een aantal glomerulaire ziektes kan nefrotische range proteïnurie gezien worden zonder bijpassende hypo-albuminemie (bijvoorbeeld bij secundaire FSGS en IgA nefropathie). Anderzijds gaat een klinisch nefrotisch syndroom niet altijd gepaard met nefrotisch range proteïnurie (zie ook figuur 4).
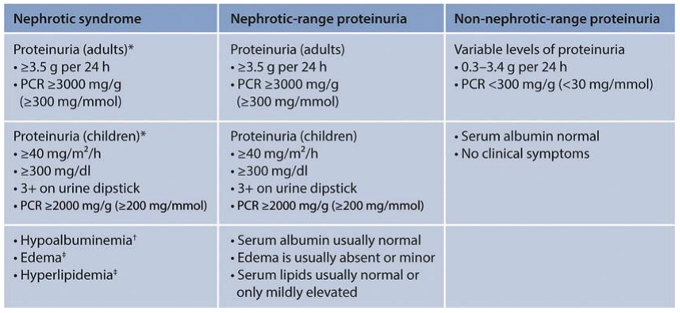
Figure 4 | Definition of “nephrotic syndrome,” “nephrotic-range proteinuria,” and “non-nephrotic-range proteinuria.” * Essential. † Laboratory-specific values: Serum albumin should be measured by bromocresol purple (BCP; colorimetric) capillary electrophoresis (CE), or immunonephelometric (iMN) methods. Bromocresol green (BCG) methods can give erroneously high results (Clase et al. 10). The values of serum albumin measured by BCG are about 5.5 g/l higher than those measured by the BCP, CE, or iMN methods, so the definition of the degree of hypoalbuminemia required to meet a definition of NS varies according to the method used for quantifying serum albumin concentration. ‡ Variable.
B. Bepaling van GFR
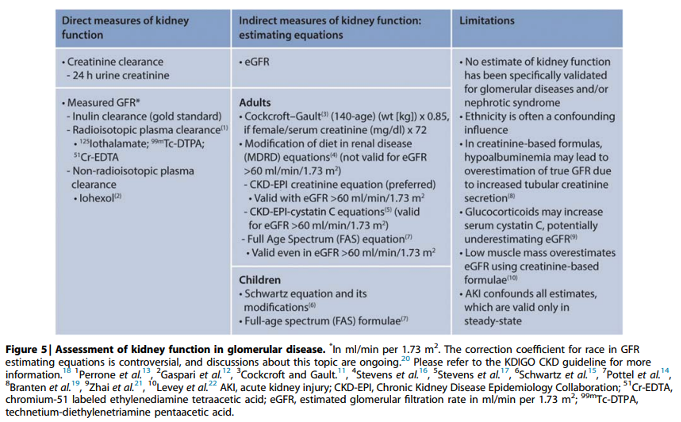
Practice Point 1.2.9: The Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) estimated glomerular filtration rate (eGFR) creatinine equation is preferred in adult patients with glomerular disease, and the modified Schwartz equation is preferred in children. The Full Age Spectrum (FAS) equation may be used in both adults and children (Figure 5).
Onderbouwing
Meeste bewijs voor behandeling van glomerulaire ziekten is gebaseerd op bepaling van nierfunctie met serum kreatinine of endogene kreatinine klaring. Alhoewel niet specifiek gevalideerd voor patiënten met glomerulaire ziekten wordt in toenemende mate gebruik gemaakt van eGFR schatting met de CKD-EPI formule.
Bij nefrotisch syndroom en hypo-albuminemie neemt tubulaire kreatinine secretie toe en kunnen kreatinine gebaseerde nierfunctie schattingen de werkelijke GFR met 50% of meer overschatten
Bij patiënten met chronische steroïd-geïnduceerde myopathie kan er bovendien sprake van afname van kreatinine productie, hetgeen ook tot overschatting van de werkelijke GFR kan leiden.
Commentaar
Zoals geadviseerd door de European Federation for Clinical Chemistry2 dient in de Nederlandse setting gekozen te worden voor de “oude” CKD-EPI formule zonder de variabele ras mee te nemen, omdat deze formule voor het overgrote deel van de niet-zwarte Nederlandse populatie beduidend beter werkt dan de nieuwe Amerikaanse formule zonder ras, met name in de CKD hoog-risico groepen, zoals ouderen, mensen met DM en mensen met een CV voorgeschiedenis.
Practice Point 1.3.1: Routine evaluation of urine sediment for erythrocyte morphology and the presence of red cell casts and/or acanthocytes is indicated in all forms of glomerular disease.
Practice Point 1.3.2: Monitoring of hematuria (magnitude and persistence) may have prognostic value in many forms of glomerular disease. This is particularly applicable to immunoglobulin A nephropathy (IgAN) and vasculitis (IgAV; Chapter 2).
Onderbouwing:
Bij glomerulonefritis zijn de erytrocyten in het urinesediment meestal (50-80%) dysmorf en klein. Erytrocytencilinders en >5% acanthocyten passen bij inflammatoire glomerulaire ziekten. Overigens zijn de kleine aantallen erytrocyten in het urinesediment van gezonde personen ook van het “glomerulaire” dysmorfe type.
Mate van persisterende glomerulaire hematurie kan belangrijke prognostische waarde hebben en wijzen op “low grade” activiteit van het onderliggende glomerulaire inflammatoire proces.
Commentaar
Voor de diagnostiek van hematurie wordt verwezen naar de Nederlandse multidisciplinaire richtlijn van de NVKC “Startpagina – Eenduidige en accurate laboratoriumdiagnostiek bij hematurie – Richtlijn – Richtlijnendatabase”
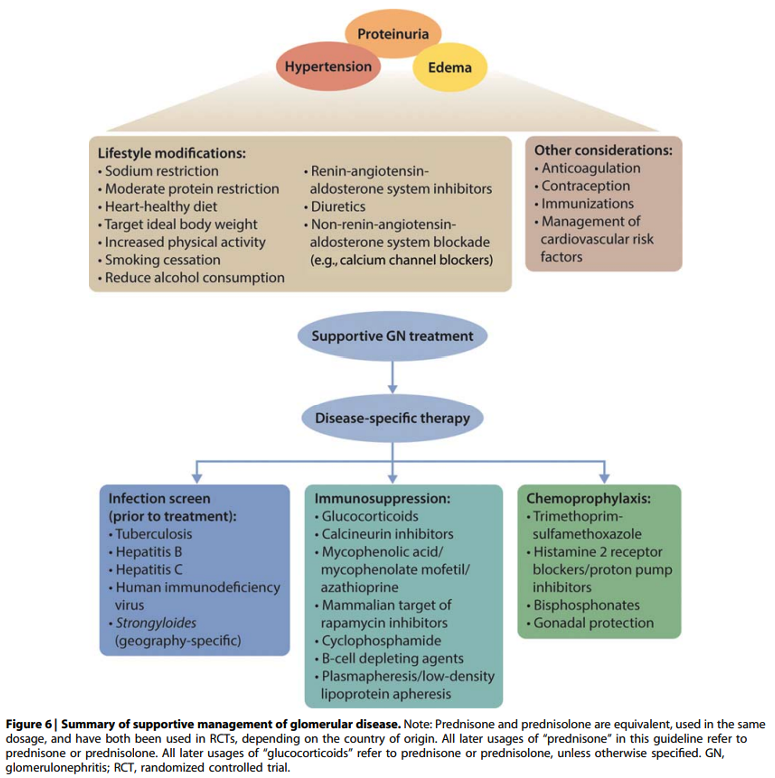
Onderbouwing
Onafhankelijk van de oorzaak van het glomerulaire lijden heeft behandeling van de bijkomende complicaties zoals weergegeven in figuur 6 een gunstig effect op het natuurlijk beloop van de ziekte en de morbiditeit en mortaliteit.
Deze ondersteunende therapie is niet vereist in steroïd-gevoelig minimal change disease (MCD) met snelle remissie en patiënten met glomerulonefritis met alleen microscopische hematurie (zoals bij vroege vormen van IgAN)
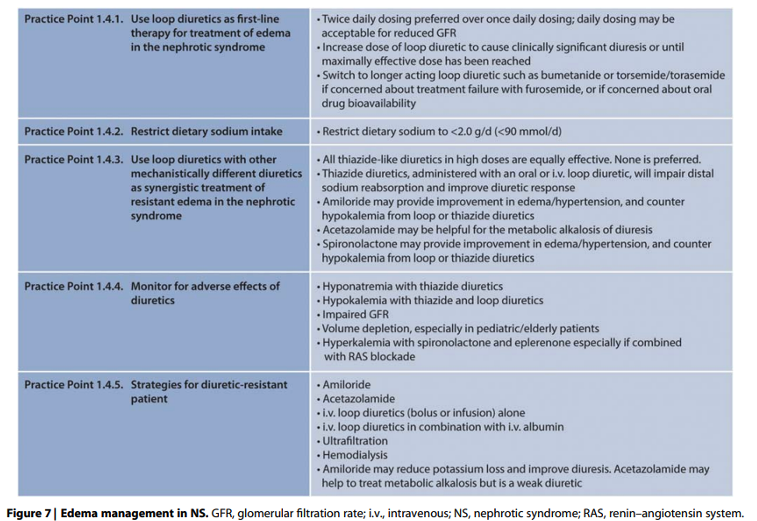
Onderbouwing
Nefrotische patiënten zijn vaak resistent tegen diuretica en frequente toediening van hogere doses van loop diuretica is meestal vereist door verminderd aanbod aan loop van Henle door groter distributievolume bij hypo-albuminemie en/of binding van diureticum in tubuli aan het gefilterde albumine.
Er is beperkt bewijs voor een gunstiger farmacokinetisch profiel en meer consistente biologische beschikbaarheid van het langer werkende bumetanide.
Bij resistentie tegen diuretica kan amiloride theoretisch een gunstig effect hebben door blokkade van het epitheliale natriumkanaal (ENaC) hetgeen geactiveerd kan worden door plasmine in nefrotische urine, maar die is helaas nooit onderzocht in RCT’s.
Verder kan de gastro-intestinale absorptie van diuretica bij ernstig nefrotisch syndroom verminderd zijn door oedeem van de darmwand waardoor er een indicatie ontstaat voor intraveneuze toediening van loop diuretica.
Resistent nefrotisch syndroom ondanks maximale dosering van intraveneus loop diuretica in combinatie met een of meerdere andere diuretica kan gevolg zijn van verminderd intravasculair volume met RAS activatie en het lijkt redelijk om in dergelijke gevallen bij patiënten met een serum albumine < 20 g/L de diuretische behandeling te combineren met toediening van 25-50 gram natriumarm intraveneus albumine ondanks het ontbreken van overtuigend onderzoeksbewijs van de effectiviteit bij volwassenen. Bovendien zal het effect van intraveneus albumine slechts kortdurend zijn doordat het albumine snel via de urine uitgescheiden zal worden.
Waterbeperking is alleen geïndiceerd bij patiënten die tijdens de behandeling hyponatriëmie ontwikkelen.
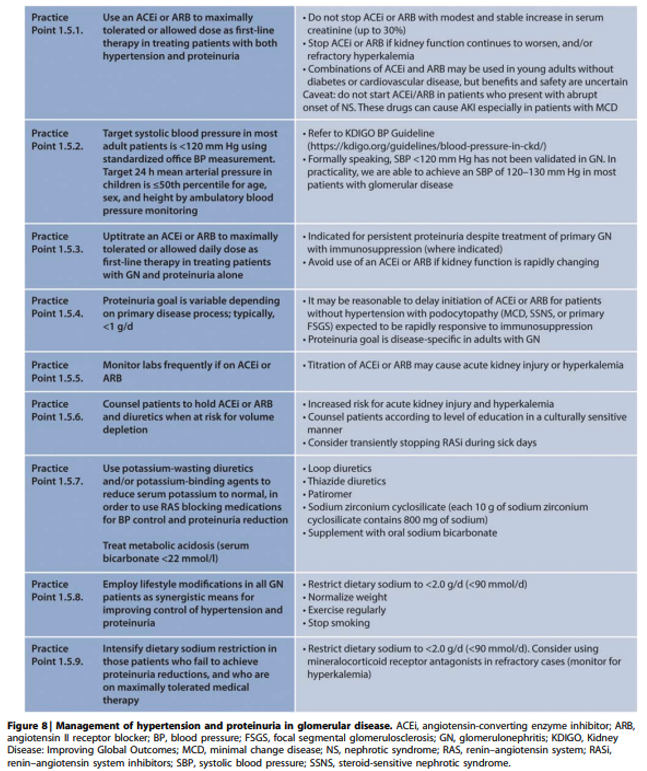
Onderbouwing
Behandeling van hypertensie bij glomerulaire ziekten is geïndiceerd enerzijds ter vermindering van het cardiovasculaire risico en anderzijds om progressief verlies van nierfunctie te vertragen of zelfs te voorkomen. Meeste onderzoeken geven aan dat achteruitgang van nierfunctie door tubulotoxische effecten van proteïnurie kan worden voorkomen door de proteïnurie te verminderen tot <0.5 g/dag en te vertragen bij afname tot <1.0‑1.5 g/dag. Bij nefrotisch syndroom geeft vermindering van proteïnurie tot non-nefrotische range stijging van het serum albumine waardoor trombo-embolische en infectierisico wordt verminderd en de kwaliteit van leven verbeterd door afname van klinische symptomen.
RAS remming met ACE-remmers (ACEi) of angiotensine receptor blockers (ARB) vormen hoeksteen van de behandeling, maar dienen niet gestart te worden bij presentatie met nefrotisch syndroom of snel veranderende nierfunctie. Ondanks ontbreken van hard bewijs wordt geadviseerd de systolische bloeddruk te verlagen tot <120 mmHg en de ACEi of ARB te continueren zo lang als kreatinine <30% stijgt. Alleen bij jongvolwassenen zonder diabetes of cardiovasculaire aandoening kan een combinatie van ACEi en ARB geprobeerd worden onder frequente controle van kreatinine en kalium. Hetzelfde geldt voor combinatie van ACEi of ARB met een directe renine remmer (DRI).
Bij intolerantie voor of onvoldoende effect van ACEi, ARB, DRI en mineraal corticoid antagonist (MRA) kunnen andere anti-hypertensiva worden geprobeerd met voorkeur voor non-hydropyridine calciumantagonisten (CCB) zoals verapamil of diltiazem gezien hun matige antiproteinurische effect. Beta-blockers, diuretica en alfa1-blokkers verlagen in mindere mate ook de proteïnurie terwijl dihydropyridine CCB zoals nifedipine weinig tot geen effect op proteïnurie hebben en deze zelfs kunnen doen toenemen als bloeddruk daarmee onvoldoende daalt.
Commentaar
Bij hyperkaliemie door RAS blokkade of MRA kan een loop- of thiazide diureticum toegevoegd worden of een bij voorkeur natriumarme kaliumbinder gestart worden, waarbij er volgens de RLC geen bewezen voordelen zijn voor de nieuwere kaliumbinders patiromer en zirconium-ciclosilaat boven Ca-polystyreen.
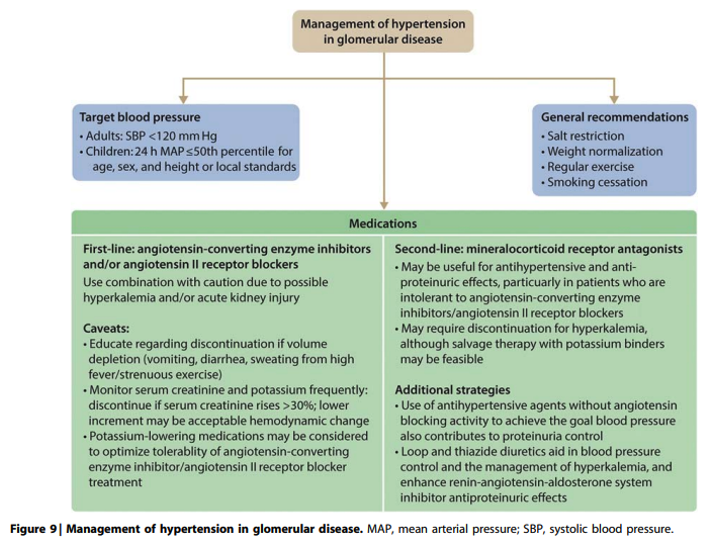
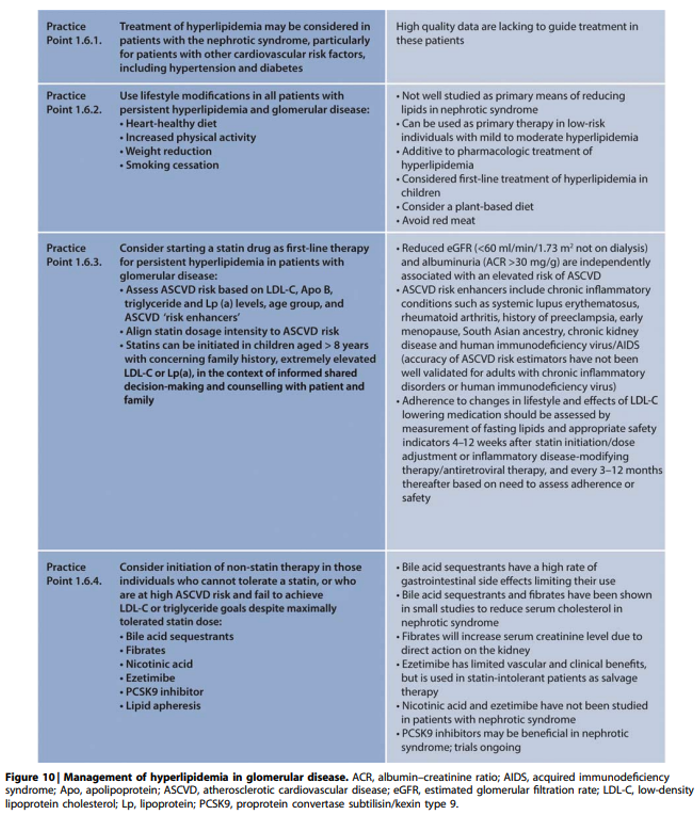
Commentaar
Gezien het ontbreken van bewijs voor (additioneel) nut van behandeling van hyperlipidemie met lifestyle interventies of medicatie bij patiënten met glomerulaire ziekten of nefrotisch syndroom is er geen reden om af te wijken van de adviezen voor behandeling van dyslipidemie in module 3.6.4 van de multidisciplinaire richtlijn “chronische nierschade”
Zoals ook geldt voor niertransplantatie patiënten dient wel rekening te worden gehouden met mogelijke interacties tussen statines en calcineurine remmers. Zoals beschreven in de LONT richtlijn “cardiovasculair risicomanagement na niertransplantatie: hypertensie en dyslipidemie” geldt dit met name voor ciclosporine. Ciclosporine vermindert de opname van statines in de lever via remming van het lever-specifieke polypeptide 1B1 (OATP1B1), wat de serumconcentratie van alle statines verhoogt. Hiernaast remt ciclosporine het CYP3A4-gemedieerde metabolisme van atorvastatine en simvastatine waardoor de concentratie van beide middelen tot 8x kan toenemen, met een hoog risico op myopathie en rhabdomyolyse tot gevolg. Hoewel tacrolimus theoretisch ook de concentratie van statines kan verhogen wordt dit in de praktijk weinig waargenomen, en kan met iedere statine worden gestart, met aandacht voor mogelijke bijwerkingen. Ditzelfde geldt voor mTOR remmers.
Practice Point 1.7.1: Full anticoagulation is indicated for patients with thromboembolic events occurring in the context of nephrotic syndrome. Prophylactic anticoagulation should be employed in patients with nephrotic syndrome when the risk of thromboembolism exceeds the estimated patient-specific risks of an anticoagulation-induced serious bleeding event (Figure 11).
Practice Point 1.7.2: Anticoagulant dosing considerations in patients with nephrotic syndrome (Figure 12 and Figure 13).
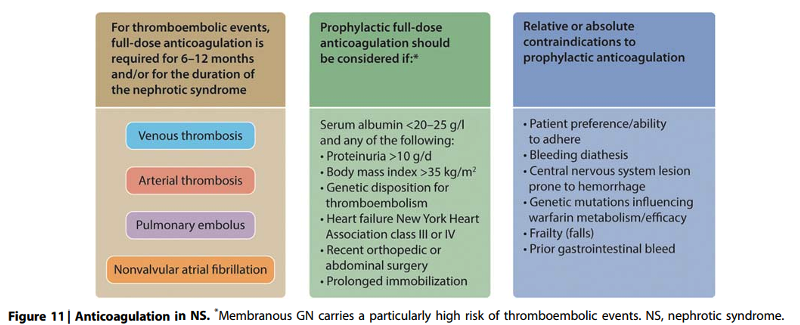
Onderbouwing
Bij nefrotisch syndroom is het risico op veneuze trombose en in mindere mate arteriële trombose vooral in de eerste 6 maanden na diagnose verhoogd, waarbij de histologische diagnose (met name membraneuze glomerulonefritis), mate van proteïnurie en het serum albumine de beste voorspellers zijn voor het trombose risico. Alle bekende risicofactoren voor trombose kunnen dit risico verder verhogen. Bij alle patiënten zal het potentiële voordeel van antistolling moeten worden afgewogen tegen het bloedingsrisico, waarbij gebruik kan worden gemaakt van de online tool voor berekening van mogelijke voordeel van antistolling voor preventie van trombose Prophylactic Anticoagulation in Patients with Membranous Nephropathy: A Decision Analysis (unc.edu). Om hiervan gebruik te kunnen maken dienen de waardes van ureum, kreatinine, albumine en hemoglobine eerst van SI-units geconverteerd moeten worden naar de conventionele units volgens onderstaande correctiefactoren, waarbij gebruik kan worden gemaakt van de online tool Clinical Biomarker Unit Conversion | Optimal DX:
Commentaar
In een Deense retrospectieve studie3 met 79 patiënten werden alleen ernstige bloedingen gezien bij patiënten met nefrotisch syndroom waarbij de profylactische antistolling met VKA of LMWH gecombineerd was met plaatjesaggregatieremmers zodat deze combinatie ontraden wordt.
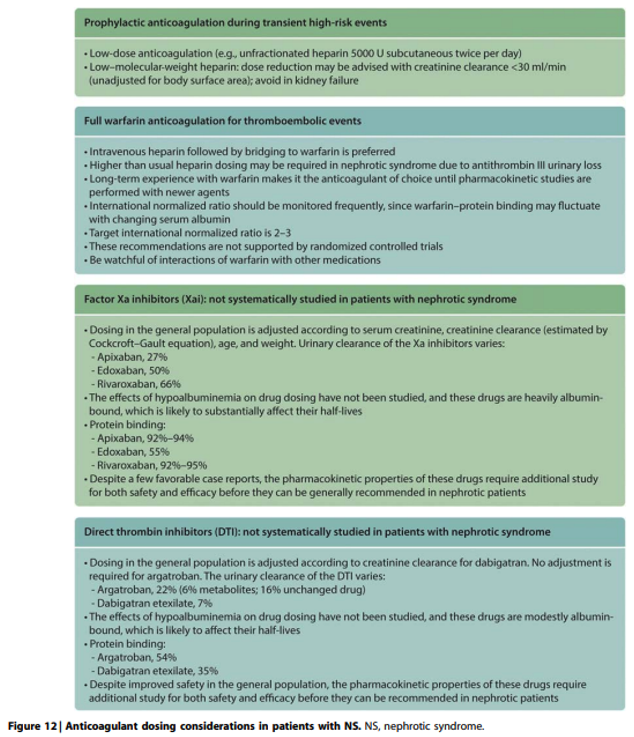
Commentaar
Na de publicatie van de KDIGO glomerular diseases zijn er twee retrospectieve onderzoeken/case series met respectievelijk 27 en 21 patiënten gepubliceerd4,5 die suggereren dat de Factor Xa antagonisten apixaban en rivaroxaban een effectief en veilig alternatief zijn voor profylactische antistolling bij nefrotisch syndroom.
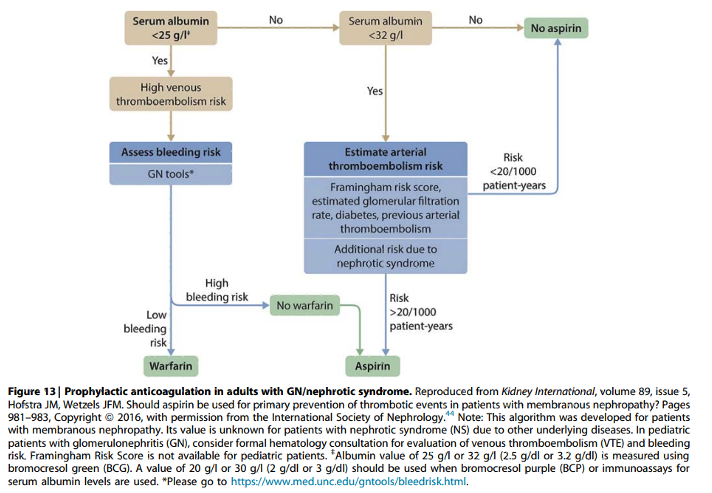
Onderbouwing
Algoritme in figuur 13 is ontwikkeld voor patiënten met nefrotisch syndroom op basis van membraneuze glomerulonefritis die ten opzichte van andere glomerulaire ziekten het hoogste risico op tromboembolische complicaties hebben. De waarde van dit algoritme voor patiënten met nefrotisch syndroom door andere glomerulaire ziekten is derhalve nog onbekend.
Het bloedingsriciso kan ingeschat worden met calculator op onderstaande website:
https://www.med.unc.edu/gntools/bleedrisk.html
Commentaar
Alhoewel het absolute risico op arteriële trombose bij nefrotisch syndroom veel lager is dan het risico op veneuze trombose is het relatieve risico op arteriële trombose in patiënten met primaire of secundaire vormen van nefrotisch syndroom gedurende 10 jaar follow-up 8x zo hoog als in de algemene populatie6, waardoor er reden kan zijn om patiënten zonder indicatie voor profylactische antistolling met warfarine te behandelen met plaatjesaggregatieremming met lage dosis acetylsalicylzuur. Overeenkomstig advies in figuur 13 kan inschatting van het risico op arteriële thromboemboliën behulpzaam zijn voor beslissing om al dan niet acetylsalicylzuur voor te schrijven7. Alleen bij patiënten van 40-79 jaar kan de Framingham risk score berekend worden met de “2018 Prevention Guidelines Tool CV risk calculator”
https://static.heart.org/riskcalc/app/index.html#!/baseline-risk.
Deze calculator geeft het percentage individueel risico op cardiovasculair event voor de komende 10 jaar, hetgeen hetzelfde is als het risico per 1000 patiëntjaren die in figuur 13 genoemd wordt. Deze incidentie dient vervolgens vermenigvuldigd te worden met het relatieve risico van 2.4 van het nefrotisch syndroom en relatieve risico van chronische nierschade (1.8 voor gele, 3.1 voor oranje en 5 voor rode categorie). Risico van diabetes is opgenomen in Framingham risk score. Verder kan het starten van corticosteroïden met hun potentiële protrombotische risico een extra reden vormen om acetylsalicylzuur voor te schrijven. Patiënten met voorgeschiedenis van arteriële tromboemboliën zullen sowieso een indicatie voor antistolling hebben en dat dan ook meestal al gebruiken.
Practice Point 1.8.1: Use pneumococcal vaccine in patients with glomerular disease and nephrotic syndrome, as well as patients with chronic kidney disease (CKD). Patients and household contacts should receive the influenza vaccine. Patients should receive herpes zoster vaccination (Shingrix).
Practice Point 1.8.2: Screen for tuberculosis (TB), hepatitis B virus (HBV), hepatitis C virus (HCV), human immunodeficiency virus (HIV), and syphilis in clinically appropriate patients (Chapter 7).
Practice Point 1.8.3: Strongyloides superinfection should be considered in patients receiving immunosuppression who once resided in endemic tropical environments and who have eosinophilia and elevated serum immunoglobulin E (IgE) levels.
Practice Point 1.8.4: Prophylactic trimethoprim– sulfamethoxazole (TMP-SMX) should be considered in patients receiving high-dose prednisone or other immunosuppressive agents (rituximab, cyclophosphamide).
Onderbouwing
Commentaar
Voor de Nederlandse situatie wordt verwezen naar de vaccinatie-adviezen bij chronisch inflammatoire aandoeningen van het RIVM (met name tabel 3.1 voor volwassenen en tabel 3.2 voor kinderen <18 jaar) en de NFN/LONT vaccinatie-adviezen pre-niertransplantatie:
De Nederlandse adviezen komen grotendeels overeen met bovenstaande practice points met als belangrijkste aandachtspunten/discrepanties:
Practice Point 1.9.1: Goals for proteinuria reduction with treatment vary among the various specific causes of glomerular disease.
Practice Point 1.9.2: A ≥40% decline in eGFR from baseline over a 2–3-year period has been suggested as a surrogate outcome measure for kidney failure.
Onderbouwing
In studies worden helaas lang niet altijd dezelfde definities gebruikt voor mate van respons van proteïnurie en lange termijn effect op nierfunctie.
Voor respons proteïnurie worden meestal de volgende definities gebruikt:
Voor lange termijn protectie tegen nierfunctieverlies lijken afname van proteïnurie >30% en afname van eGFR ml/min/1.73m2 <40% in 2-3 jaar in onderzoeken redelijke surrogaat markers te zijn maar het is nog onduidelijk of deze maten ook in de dagelijkse klinische praktijk goede voorspellers zullen zijn.
Geen practice points
Onderbouwing
Doordat er weinig tot geen grotere RCTs beschikbaar zijn voor de behandeling van de verschillende en vaak relatief zeldzame glomerulaire ziektes is het onzeker of de resultaten uit de onderzoeken ook in de klinische praktijk toepasbaar zijn voor patiënten met andere leeftijd, geslacht en/of etniciteit.
Ook de invloed van farmacogenetische variaties op farmacokinetiek/farmacodynamiek van de verschillende immuunsuppressiva is nog grotendeels onbekend.
Geen practice points
Onderbouwing
De rol van genomics, transcriptomics, proteomics en/of metabolomics bij “gepersonaliseerde” cq “precisie” behandeling lijkt veelbelovend maar is op dit moment voor de meeste glomerulaire ziekten het “proof-of-concept” stadium nog niet gepasseerd.
Onderbouwing
Voor start van immuunsuppressie dienen patiënt en eventueel familie uitgebreid gecounseld te worden over de mogelijke voordelen en risico’s/bijwerkingen van de behandeling.
Bij meer intensieve immuunsuppressie dienen profylactische maatregelen genomen te worden om de potentiële bijwerkingen te minimaliseren (zie tabel 14). Specifieke aandachtspunten hierbij:
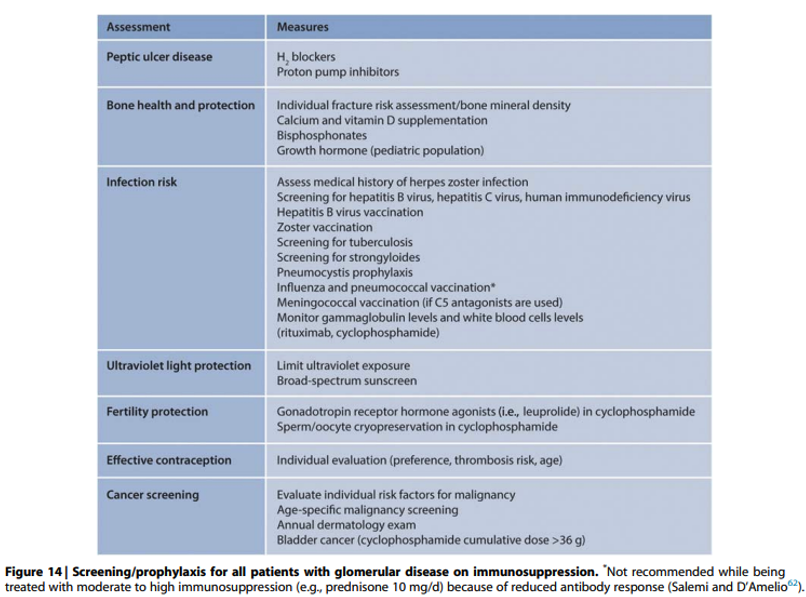
Onderbouwing
Voor adviezen voor vrouwen en mannen met glomerulaire ziekten en kinderwens dient geen gebruik te worden gemaakt van deze KDIGO richtlijn, maar wordt verwezen naar de Nederlandse FMS multidisciplinaire richtlijn “kinderwens en zwangerschap bij chronische nierschade”
Practice Point 1.16.1: Patients with glomerular disease should be offered participation in a disease registry and clinical trials, whenever available.
Onderbouwing
Deel van de geadviseerde immunosuppressiva zijn nog (erg) kostbaar, maar door komst van generieke middelen en biosimilars dalen deze kosten snel. Daarbij moet er wel voor gewaakt worden dat variaties in biologische beschikbaarheid de effectiviteit niet nadelig beïnvloeden.
Geen practice points
Onderbouwing
Doelen van behandeling zijn in het algemeen:
Geen practice points
Onderbouwing
Vrijwel alle glomerulaire ziekten kunnen recidiveren na niertransplantatie en vormen de 2e of 3e meest voorkomende oorzaak van transplantaatfalen. Alleen bij extreem hoog risico op recidief wordt levende donor transplantatie ontraden. Er zijn helaas nog geen bewezen strategieën om recidieven te voorkomen.
© 2022. Alle rechten voorbehouden