Behandeling diabetes mellitus en chronische nierschade stadium 3b of hoger
Autorisatiedatum:
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
De richtlijnencommissie van de NfN heeft de ERBP richtlijn “Clinical Practice Guideline on management of patients with diabetes and chronic kidney disease stage 3b or higher” beoordeeld, met toevoeging van recente data.
De richtlijn bestaat uit drie onderdelen gericht op de behandeling van patiënten met CKD 3b of hoger (eGFR < 45 ml/min/1.73m2) en DM type 1 of 2.
In het eerste deel worden stellingen geformuleerd ten aanzien van nierfunctievervangende therapie.
In het tweede deel worden stellingen geformuleerd ten aanzien van de diabetesregulatie. De streefwaardes voor HbA1c zijn gedifferentieerd, rekening houdend met levensverwachting en comorbiditeit. De overwegingen bij de keuze tussen de diverse bloedglucoseverlagende middelen worden toegelicht. Hierbij zijn ook recente studies met relevante bevindingen op cardiovasculaire en renale eindpunten verwerkt.
In het derde deel staan stellingen ten aanzien van het cardiovasculaire risicomanagement. De Nederlandse Vereniging voor Cardiologie (NVVC) heeft een deel van deze stellingen mede beoordeeld en hun commentaar is bijgevoegd.
This clinical practice guideline was designed to facilitate informed decision-making on the management of adult individuals with diabetes mellitus and CKD stage 3b or higher (eGFR <45 mL/min). It was not intended to define a standard of care, and should not be construed as such. It should not be interpreted as a prescription for an exclusive course of management.
This guideline intends to support clinical decision making by any health care professional caring for patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min).
Rating the quality of the evidence for each outcome across studies
Table. Grade for the overall quality of evidence. Adapted from Guyatt et al. [Guyatt BMJ 2008;924]
|
GRADE |
Quality level |
Definition |
|
A |
High |
We are confident that the true effects lie close to those of the estimates of the effect.
|
|
B |
Moderate |
The true effects are likely to be close to the estimates of the effects, but there is a possibility that they are substantially different.
|
|
C |
Low |
The true effects might be substantially different from the estimates of effects.
|
|
D |
Very low |
The estimates are very uncertain and will often be far from the truth.
|
Formulating and grading statements
Table. Implications of strong and weak recommendations for stakeholders. Adapted from Guyatt et al. [Guyatt BMJ 2008:1049]
|
GRADE |
Implications Patients |
Clinicians |
Policy |
|
1: Strong, ‘We recommend’ |
Most people in your situation would want the recommended course of action, only a small proportion would not.
|
Most patients should receive the recommended course of action.
|
The recommendation can be adopted a as policy in most situations.
|
|
2: Weak, ‘We suggest’ |
Most people in your situation would want the recommended course of action, but many would not.
|
You should recognize that different choices will be appropriate for different patients. You must help each patient to arrive at a management decision consistent with her or his values and preferences.
|
Policy-making will require substantial debate and involvement of many stakeholders. |
The additional category ‘ungraded’ was used, typically, to provide guidance based on common sense rather than on a systematic literature search. Where applicable, these statements were
provided as ‘advice for clinical practice’. Typical examples include recommendations regarding monitoring intervals, counselling and referral to other clinical specialists. The ungraded
recommendations are generally written as simple declarative statements, but are not meant to be interpreted as being stronger recommendations than level 1 or 2 recommendations.
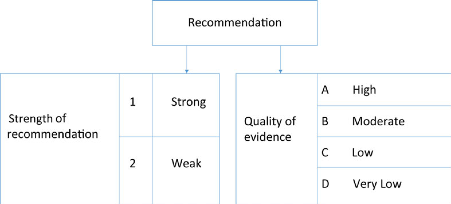
FIGURE 1 : Grade system for grading recommendations. Adapted from Guyatt et al. [Guyatt BMJ 2008;924]].
ABBREVIATIONS AND ACRONYMS
|
CKD |
Chronic kidney disease |
|
ACE-I |
ACE inhibitor |
|
ERA-EDTA |
European Renal Association – European Dialysis and Transplant Association |
|
ERBP |
European Renal Best Practice |
|
MD |
Mean difference |
|
OR |
Odds ratio |
|
RR |
Relative risk |
|
95% CI |
95% Confidence interval |
Indeling van een hoofdstuk
Elk hoofdstuk begint met de Statements en Advice for clinical practice overgenomen uit de ERBP richtlijn, in het Engels. De daaronder staande verantwoording is de in het Nederlands vertaalde verantwoording van de ERBP werkgroep voor de statements. Indien er aanvulling of commentaar op de ERBP stellingen is van richtlijnencommissie NFN of andere beoordelaars is dit toegevoegd in Commentaar.
Population.
The guideline covers adults with diabetes mellitus and CKD stage 3b or higher (eGFR <45 mL/min), as defined by the recent KDIGO classification [Levey, KI 2005]. The guideline does not cover interventions in patients with diabetes and CKD stages 1–2 to prevent or delay development of micro- or macro-albuminuria.
Conditions.
The guideline specifically covers the management of patients with diabetes mellitus and CKD stage 3b or higher (eGFR <45 mL/min), with a focus on three major areas:
(i) selection of renal replacement modality; (ii) management of glycaemic control;
(iii) management and prevention of cardiovascular comorbidity.
Clinical management.
The guideline intends to provide an evidence-based rationale for the day-to-day management
of patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min), and to develop pathways of care by systematically compiling available evidence in this area. It provides an evidence-based rationale on why management of patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min) should or should not be different from patients with diabetes but without CKD stage 3b or higher (eGFR <45 mL/min), or from patients with CKD stage 3b or higher (eGFR <45 mL/min) but without diabetes.
Statements
1.1.1 We recommend giving priority to the patient’s general status and preference in selecting renal replacement therapy as there is an absence of evidence of superiority of one modality over another in patients with diabetes and CKD stage 5 (1C).
1.1.2 We recommend providing patients with unbiased information about the different available treatment options (1A).
1.1.3 In patients opting to start haemodialysis (HD), we suggest prefering high flux over low flux when this is available (2C).
1.1.4 We suggest diabetes has no influence on the choice between HD or haemodiafiltration (HDF) (2B).
Advice for clinical practice
Making sure that all the different renal replacement therapy modalities (peritoneal dialysis (PD), in-centre HD, satellite HD, home HD, nocturnal dialysis, different modalities of transplantation) can be made equally available for all patients is indispensable to allow free modality choice.
Verantwoording:
Stelling 1.1.1 en 1.1.2
Studies naar het effect van de dialysemodaliteit op de overleving en quality-of-life zijn voornamelijk observationeel, en zijn vaak niet specifiek ontworpen om deze patiëntenpopulatie te onderzoeken. Hierdoor zijn er methodologische beperkingen (selectie bias, beperkte uitkomstvariabelen, onvoldoende details over aard van de therapie), waardoor er geen harde conclusies kunnen worden getrokken. Er zijn studies waarbij bij intention-to-treat analyse een overlevingsvoordeel wordt gezien voor patiënten behandeld middels peritoneale dialyse, echter dit voordeel verdwijnt na verloop van tijd, afhankelijk van comorbiditeit na 0.5 tot 3 jaren (data in ERBP richtlijn). Verder tonen “as treated” analyses een meer heterogeen effect, waarbij peritoneale dialyse in sommige studies is geassocieerd met een verbeterde overleving, maar in andere studies met verhoogde mortaliteit (Noordzij NDT 2012, Termorshuizen JASN 2003, Fenton AJKD 1997, Weinhandl JASN 2010, Yeates NDT 2012, Stack KI 2003). Bovendien zijn de gevonden verschillen in overleving klein, waardoor de verschillende behandelvormen hemodialyse en peritoneale dialyse door de guideline commissie van de ERBP zijn beoordeeld als “equally adequate treatments”. Om deze redenen adviseert deze commissie dat alle behandelopties voor de patiënt beschikbaar zijn en besproken worden.
1.1.3
Indien gekozen wordt voor hemodialyse wordt aangeraden om gebruik te maken van high-flux kunstnieren, conform de elders geformuleerde ERBP aanbevelingen over het gebruik van high- versus low-flux membranen (Tattersall NDT 2010).
1.1.4
Bij een recente meta-analyse bleek het al dan niet hebben van diabetes mellitus geen invloed te hebben op de uitkomstverschillen bij toepassen van HDF dan wel HD en diabetes mellitus is dan ook niet van invloed op de keuze tussen beide dialysetechnieken (Nistor AJKD 2014).
Commentaar richtlijnencommissie:
De richtlijnencommissie suggereert om post-dilutie HDF toe te passen op grond van de resultaten van de Contrast-studie, conform de richtlijn “Dialysestrategie en dialyse-efficiëntie”.
Statements
1.2.1 We recommend initiating dialysis in patients with diabetes on the same criteria as in patients without diabetes (1A).
Advice for clinical practice
nausea on uraemia etc.) from uraemic complaints might be cumbersome in clinical practice.
(a) speed of deterioration of renal function
(b) projected probability that a functioning vascular access will be achieved
(c) projected life expectancy.
Verantwoording:
Gebaseerd op de beperkte, beschikbare onderzoekdata is er geen evidence voor de hypothese dat bij een patiënt met diabetes mellitus een vroege start van dialyse, voordat de patiënt uremische symptomen heeft, een voordeel oplevert in overleving of quality-of-life (Cooper NEJM 2010, Coronel Scand JUN 2009, Kazmi AJKD 2005, Traynor JASN 2002, Wright Clin JASN 2010, Hwang NDT 2010). Om deze reden is de aanbeveling over starten van dialyse bij patiënten met DM gelijk aan de elders geformuleerde richtlijn van de ERBP voor de algemene populatie patiënten met CKD 5. Wel kan het bij patiënten met DM lastig zijn om uremische klachten te onderscheiden van diabetesgerelateerde symptomen. In individuele gevallen kan gekozen worden voor een vroegere start van dialyse, als het onderscheid tussen uremische en diabetesgerelateerde klachten niet goed kan worden gemaakt.
Bij patiënten met DM kunnen het aanleggen en ontwikkelen van een AV-shunt problematisch verlopen. Om deze reden is vroege besluitvorming en keuze voor de dialysemodaliteit bij patiënten met DM van belang, met name bij snelle progressie van de nierinsufficiëntie en bij een levensverwachting die lang genoeg is om starten met dialyseren te kunnen verwachten.
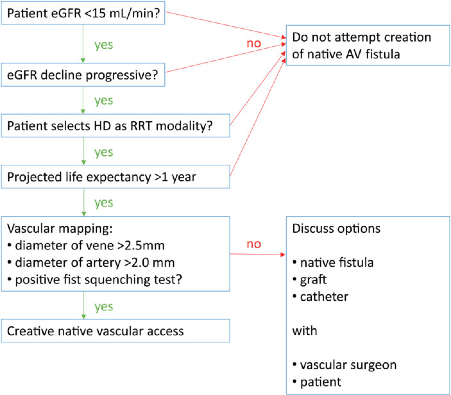
In figuur 2 worden de afwegingen bij het aanleggen van een AV-shunt weergegeven.
FIGURE 2 : Decision flow chart for vascular access in patients with diabetes.
Commentaar richtlijnencommissie:
De richtlijnencommissie adviseert om bij een eGFR < 20 ml/min/1.73m2 afhankelijk van de snelheid van progressie van de nierinsufficiëntie het aanleggen van een AV-shunt te overwegen. Verder adviseert de richtlijnencommissie om bij keuze voor peritoneale dialyse zorg te dragen voor tijdige beoordeling van de buik op corrigeerbare (chirurgische) contra-indicaties zoals buikwandherniaties.
Statements
1.3.1 We recommend that reasonable effort be made to avoid tunnelled catheters as primary access in patients with diabetes starting HD as renal replacement therapy (1C).
1.3.2 We recommend that the advantages, disadvantages and risks of each type of access be discussed with the patient.
Advice for clinical practice
Verantwoording:
Uit observationele studies blijkt dat bij starten met hemodialyse patiënten met een functionerende natieve AV-shunt een betere uitkomst hebben dan patiënten die starten met een katheter. Er kan hierbij echter sprake zijn van confounding, aangezien het niet hebben van een functionerende fistel een gevolg kan zijn van de slechte conditie van patiënt. Verder kan het aanleggen van een AV-shunt, met name distaal, bemoeilijkt worden door vaatlijden.
In een systematische review (Ravani JASN 2013) werd gevonden dat het starten met een katheter vs starten met een functionerende AV-fistel of graft in de algemene dialysepopulatie is geassocieerd met een hogere mortaliteit, een groter risico op een fatale infectie en een grotere kans op cardiovasculaire events. Toegang middels een graft vs toegang middels een natieve AV-fistel bleek geassocieerd met een verhoogde mortaliteit en een verhoogde kans op fatale infecties, echter geen verschil in cardiovasculaire events. Bij deze effecten kan wel sprake zijn geweest van selectiebias tgv de associatie tussen cardiovasculaire status en de mogelijkheden om een AV-shunt aan te leggen. Verder wordt bij een aantal studies de positie van de centrale lijn niet vermeld of is sprake van een femoralislijn. (Saxena Kidney BPR 2002)
Wetenschappelijke evidence bij de besluitvorming om al dan niet een av-shunt te laten aanleggen is beperkt. De algemene opinie is dat aanleg van een AV-shunt bij DM lastiger is en dat er vaker sprake is van een slechte ontwikkeling van de AV-shunt, met name bij vrouwen en ouderen. Het risico op problemen bij het aanleggen van een shunt is met name verhoogd als de diameter van de aanvoerende arterie < 2 mm is en/of als de diameter van de afvoerende vene < 2.5 mm is. Verder wordt geadviseerd om de verwachte levensduur van de patiënt mee te wegen bij de besluitvorming om een av-shunt aan te laten leggen.
Er volgt nog een formele systematische review als ondersteuning bij de revisie van de ERBP guideline voor vascular access.
Commentaar richtlijnencommissie:
Gezien de beperkte onderzoeksgegevens adviseert de richtlijnencommissie om een individuele afweging te maken bij de keuze voor hemodialysetoegang, daarbij ook rekening houdend met de verhoogde kans op ischemische en cardiale complicaties , m.n. bij een AV-shunt t.h.v. de bovenarm of bij gebruik van een PTFE-loop.
Statements
1.4.1 We recommend providing education on the different options of transplantation and their
expected outcomes for patients with diabetes and CKD stage 4 or 5 who are deemed suitable for transplantation (Table 5 ) (1D).(Clin Prac Guideline NDT 2015)
Statements only for patients with type 1 diabetes and CKD stage 5
1.4.2 We suggest living donation kidney transplantation or simultaneous pancreas kidney transplantation to improve survival of suitable patients (2C).
1.4.3 We suggest against islet transplantation after kidney transplantation with the aim to improve survival (2C).
1.4.4 We suggest pancreas grafting to improve survival after kidney transplantation (2C).
Statements only for patients with type 2 diabetes and CKD stage 5
1.4.5 We recommend against pancreas or simultaneous kidney pancreas transplantation (1D).
1.4.6 We recommend diabetes in itself should not be considered a contraindication to kidney transplantation in patients who otherwise comply with inclusion and exclusion criteria for transplantation (1C).
Advice for clinical practice
Verantwoording:
Bij patiënten met DM en CKD stadium 3b of hoger is meestal sprake van uitgebreide en complexe comorbiditeit. Na transplantatie kunnen de diabetesregulatie en de cardiovasculaire status verslechteren door de immunosuppressieve medicatie. Echter overleving en quality-of-life bij behandeling middels dialyse zijn ook suboptimaal. Besluitvorming bij de keuze voor dialyse dan wel de verschillende vormen van nier- en pancreastransplantatie is daardoor complex.
De beoordeling van de effecten van verschillende vormen van niertransplantatie en pancreastransplantatie is moeilijk doordat er veel observationele studies zijn met methodologische beperkingen (selectiebias, centrumbias, onduidelijkheid over het type DM en comorbiditeit). Een weergave van de geëvalueerde literatuur is na te lezen in de ERBP richtlijn.
De mortaliteit na niertransplantatie lijkt hoger te zijn bij patiënten met DM versus patiënten zonder DM (Sorensen Diab 2007, Keddis KI 2014). Patiënten met DM die een niertransplantatie hebben ondergaan, hebben een betere overleving dan patiënten die nog op de wachtlijst staan (Wolfe NEJM 1999, Sorensen Diab 2007).
Bij DM type 1 wordt in de meeste studies gevonden dat de langetermijnuitkomsten beter zijn na simultane pancreas-niertransplantatie dan na niertransplantatie alleen (Sollinger Ann S 2009, Becker KI 2000, Lindahl Diab 2013, Mohan Br JS 2003,Morath JASN 2008). De gevonden verbetering in overleving is echter inconsistent, en wordt ook beïnvloed door het type niertransplantatie (postmortaal of levende donatie), de follow-upduur van het onderzoek en de immunosuppressieve behandeling. Bij studies naar het effect van gecombineerde nier-pancreas transplantatie bij DM type 1 kan er sprake zijn van selectiebias, waarbij de patiënten met de beste conditie geselecteerd worden, de operaties plaatsvinden in grote high-volumecentra en patiënten vaker preëmptief worden geopereerd. Onderzoek naar quality-of-life is divers van opzet, waardoor geen gegeneraliseerde uitspraken kunnen worden gedaan.
Indien een patiënt met DM type 2 volgens de richtlijnen gescreend wordt voorafgaand aan de niertransplantatie, waarbij met name intensief gescreend wordt op cardiovasculaire comorbiditeit, dan is na de niertransplantatie de diagnose DM geen onafhankelijke prognostische factor (Abramowicz NDT 2014).
De richtlijnwerkgroep van de ERBP is van mening dat de voorkeur uitgaat naar een niertransplantatie middels een levendedonornier, indien deze beschikbaar is, met als argumenten dat hierdoor de donorpool wordt uitgebreid, en dat de resultaten van een levendedonorniertransplantatie niet inferieur zijn aan een gecombineerde nier-pancreastransplantatie. Indien er geen levendedonornier beschikbaar is, gaat de voorkeur uit naar een gecombineerde nier-pancreastransplantatie, mits de conditie van patiënt hiervoor toereikend is.
FIGURE 3 : Transplantation decision flow chart for patients with type 1 diabetes.
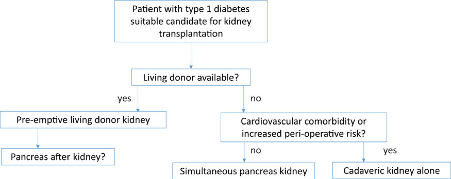
Commentaar richtlijnencommissie:
De transplantatiecentra waar pancreastransplantaties worden verricht (UMC Groningen en LUMC) adviseren om bij een patiënt met DM type 1 de voorbereidingen voor een nier-pancreastransplantatie te starten bij een eGFR < 30 ml/min/1.73m2.
In principe gaat de voorkeur uit naar een nier-pancreastransplantatie. Als de verwachte wachttijd hiervoor lang is (arbitrair 1 jaar), dan wordt met patiënt de optie van een niertransplantatie met levende donatie besproken. Bij de besluitvorming wordt het extra risico van een additionele pancreas-na-niertransplantatie betrokken.
Statements
2.1.1 We recommend against tighter glycaemic control if this results in severe hypoglycaemic episodes (1B).
2.1.2 We recommend vigilant attempts to tighten glycaemic control with the intention to lower HbA1C when values are >8.5% (69 mmol/mol) (1C).
2.1.3 We suggest vigilant attempts to tighten glycaemic control with the intention to lower HbA1C according to the flow chart in Figure 4 in all other conditions (2D).
2.1.4 We recommend intense self-monitoring only to avoid hypoglycaemia in patients at high risk for hypoglycaemia (2D).
Advice for clinical practice
Verantwoording:
In een recente systematische review bij dialysepatiënten werd gevonden dat zowel patiënten met een HbA1c > 69 mmol/mol als patiënten met een HbA1c < 36 mmol/mol een hogere mortaliteit hadden dan patiënten met een HbA1c tussen 48 en 57 mmol/mol (Hill AJKD 2014). In een andere studie resulteerde toevoeging van saxagliptine in een verlaging van de HbA1c lager dan 53 mmol/mol, echter de cardiovasculaire uitkomst werd hierdoor niet verbeterd (Scirica NEJM 2013).
Afgezien van deze twee studies zijn er geen specifieke studies naar de invloed van de diabetesregulatie op de prognose bij patiënten met CKD 3b of hoger. In veel diabetesstudies zijn deze patiënten uitgesloten van deelname of niet separaat geanalyseerd.
Aangezien de wetenschappelijke gegevens beperkt zijn, heeft de richtlijncommissie van de ERBP aanbevelingen geformuleerd op basis van de data van de algemene populatie met daarbij aanpassingen gericht op de patiënten met een verminderde nierfunctie.
In de algemene populatie leidt strikte glucoseregulatie (< 53 mmol/mol) niet tot verbetering van de all-cause en cardiovasculaire mortaliteit terwijl het risico op hypoglykemie toeneemt. De ERBP acht het waarschijnlijk dat dit in sterkere mate geldt voor patiënten met CKD 3b, die toch al een beperkte levensverwachting hebben. Om deze reden wordt een geïndividualiseerd beleid geadviseerd, waarbij afhankelijk van de comorbiditeit en de levensverwachting van patiënt een streefwaarde voor HbA1c wordt vastgesteld (Fig 4).
Intensieve zelfmonitoring wordt niet aanbevolen om een lagere HbA1c waarde te bereiken, maar wel om bij verhoogd risico hypoglykemieën te voorkomen. Dit betreft met name patiënten die behandeld worden met insuline (Fig 5).
Commentaar richtlijnencommissie:
De adviezen in de ERBP richtlijn komen overeen met de in de multidisciplinaire richtlijn “chronische nierschade” aanbevolen streefwaardes voor HbA1c.
Streef een HbA1c < 53 mmol/mol (<=7.0%) na om microvasculaire complicaties te voorkomen dan wel progressie hiervan te vertragen, tenzij de patiënt een hoog risico heeft op hypoglykemieën, bij veel comorbiditeit en bij een beperkte levensverwachting. Bij een leeftijd > 70 jaar, en bij een uitgebreidere behandeling dan alleen leefstijladviezen en metformin monotherapie, wordt een HbA1c <= 58 mmol/mol (<= 7.5%) aangeraden bij een diabetesduur < 10 jaar, en een HbA1c <= 64 mmol/mol (<= 8.0 %) bij een diabetesduur > 10 jaar.
FIGURE 4 : Flowchart of management targets for HbA1C in patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min/1,73 m2).
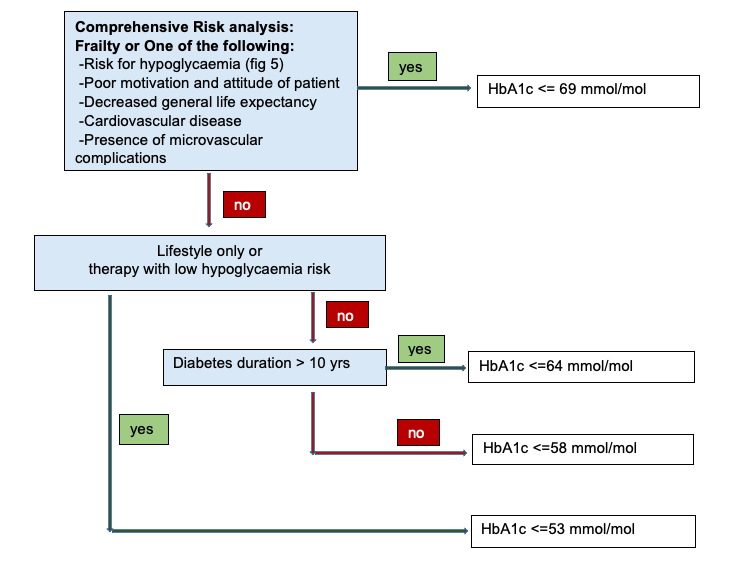
FIGURE 5 : Assessment of risk for hypoglycaemia.

Statements
2.2.1 We recommend the use of HbA1C as a routine reference to assess longer term glycaemic control in patients with CKD stage 3b or higher (eGFR <45 mL/min/1.73 m2)
(1C).
Advice for clinical practice
Verantwoording:
Bij patiënten met CKD 3b kan er een gewijzigde relatie bestaan tussen de glykemische controle en HbA1c waarde enerzijds, en morbiditeit en mortaliteit anderzijds. Van alternatieve glykemische markers zoals geglycosyleerd albumine, fructosamine, 1,5-anhydroglucitol (1,5-AG) en continue glucosemonitoring, is de meerwaarde niet aangetoond (Speeckaert NDT 2014). Verder is de HbA1c bepaling een eenvoudig beschikbare routinebepaling. Om deze redenen wordt aanbevolen om het HbA1c als standaardmaat voor de glykemische controle te handhaven.
Commentaar richtlijnencommissie:
Afhankelijk van de laboratoriumtechniek kan bepaling van het HbA1c-gehalte gestoord worden door gecarboxyleerd hemoglobine.
Statements
2.3.1 We recommend metformin in a dose adapted to renal function as a first line agent when lifestyle measures alone are insufficient to get HbA1C in the desired range according to Figure 4 (1B).
2.3.2 We recommend adding on a drug with a low risk for hypoglycaemia (fig 5, 6 and 7) as additional agent when improvement of glycaemic control is deemed appropriate according to Figure 4 (1B).
2.3.3 We recommend instructing patients to temporarily withdraw metformin in conditions of pending dehydration, when undergoing contrast media investigations, or in situations with an increased risk for AKI (1C).
Advice for clinical practice
Verantwoording:
Goede glykemische controle is van belang bij het vertragen van de progressie van micro- en macrovasculaire complicaties bij DM en CKD. Recente literatuur suggereert dat niet alle diabetesmedicatie even effectief is bij de reductie van mortaliteit en cardiovasculaire aandoeningen. Zie voor het werkingsmechanisme van de medicatie tabel 7, en voor de dosisaanpassingen en de effectiviteit Figuur 6 en 7.
2.3.1
Gebruik van metformin geeft een reductie van all-cause en cardiovasculaire mortaliteit, het is niet geassocieerd met gewichtstoename en de kans op hypoglykemieën is klein. Er is geen evidence voor een verhoogd risico op lactaatacidose. Lactaatacidose treedt op indien metformin in een dosering wordt ingenomen die te hoog is gerelateerd aan de nierfunctie. Waakzaamheid blijft daarom geboden, m.n. bij intercurrente aandoeningen waarbij acute verslechtering van de nierfunctie kan optreden. Maar gezien het gunstige effect van metformin wordt aanbevolen om metformin ook bij CKD 3b en CKD 4 voor te schrijven, in aangepaste dosering. Daarbij moet de patiënt geïnstrueerd worden om in situaties waarbij een verhoogd risico bestaat op acute verslechtering van de nierfunctie, de inname van metformin tijdelijk te staken.
2.3.2
Toevoeging van glucoseverlagende medicatie aan metformin kan worden overwogen, om de streefwaarde van HbA1c te bereiken. De argumenten bij het maken van een keuze voor de diabetesmedicatie staan omschreven in de ERBP richtlijn. Bij het maken van een keuze tussen de verschillende therapeutische opties worden in de ERBP richtlijn twee basisadviezen gegeven:
Table 7. Oral glycaemia-lowering drugs: mechanisms of action
|
Drug class |
Mechanisms of action |
Examples (alphabetical order) |
|
Biguanides |
|
Metformin
|
|
Sulfonylureas |
|
Acetohexamide, chlorpropamide, glibenclamide, gliclazide, glyburide, glimeperide, glipizide, gliquidone |
|
Meglitinides |
|
Nateglinide, repaglinide
|
|
Alfa glucosidase inhibitors |
|
Acarbose, miglitol
|
|
Glitazones |
|
Pioglitazone
|
|
DPP-IV inhibitors |
|
Alogliptin, linagliptin, saxagliptin, sitagliptin, vildagliptin |
|
Incretin mimetics |
|
Eexenatide, liraglutide, lixisenatide
|
|
Amylin analogues |
|
Pramlinitide
|
|
SLT-2 inhibitors |
|
Canagliflozin, dapagliflozin, empagliflozin
|
FIGURE 6 : Dose recommendations in CKD.
Opmerkingen richtlijnencommissie NfN: In de LEADER trial is liruglutide voorgeschreven bij alle stadia van CKD. In de EMPA-REG studie is empagliflozine voorgeschreven tot eGFR 30 ml/min/1.73m2.
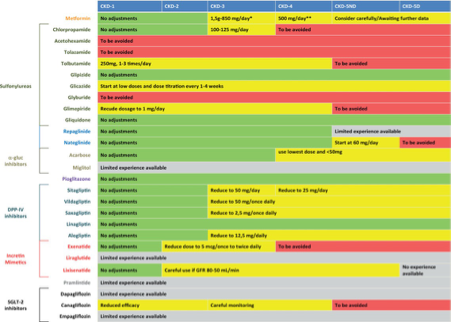
FIGURE 7 : Impact of different classes of glycaemia-lowering drugs on different outcomes. (For full data extraction: see Supplementary tables)
Opmerkingen richtlijnencommissie: Gegevens betreffende effect op mortaliteit en cardiovasculaire events achterhaald voor liraglutide, canagliflozine en empagliflozine.
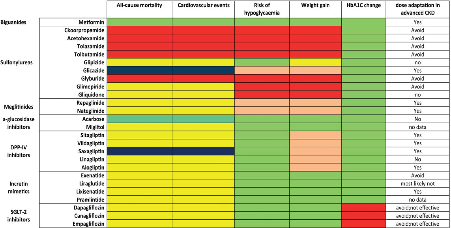
Dark green denotes evidence for beneficial effect; red indicates evidence for negative effect; yellow represents not investigated or insufficient data; salmon denotes evidence for weak negative effect; aquamarin represents evidence for neutral to weak positive effect; dark blue indicates evidence for lack of effect/neutral.
Commentaar richtlijnencommissie:
Op het moment van opstellen van de ERBP richtlijn waren er nog geen gegevens over de langetermijneffecten van SLGT2-remmers, GLP1-agonisten, DPP4 remmers en pioglitazone, m.n. t.a.v. harde cardiovasculaire en renale uitkomsten. De gegevens in tabel 6 en 7 zijn hierdoor deels achterhaald.
De volgende criteria zijn van belang bij het maken van de keuze van de diabetesmedicatie:
Ten aanzien van langetermijneffecten op (cardiovasculaire) mortaliteit en morbiditeit en op de ontwikkeling van diabetische nefropathie zijn er recent belangrijke publicaties verschenen.
SGLT2-remmers:
EMPA-REG outcome trial: empaglifozine vs placebo resulteert in reductie van het primaire cardiovasculaire eindpunt (cardiovasculair overlijden, acuut coronair syndroom en CVA) (12.1 vs 10.5%, HR 0,86 (0,74-0,99)). Verder resulteert empaglifozine in reductie van het primaire renale eindpunt (progressie macroalbuminurie, verdubbeling serum creatinine, bereiken ESRD) (12.7 vs 18.8%, HR 0,61 (0,53-0,70)). De US FDA heeft op basis van deze studie een nieuwe indicatie voor empaglifozine goedgekeurd: reductie van CV mortaliteit bij DM type 2 en bekende cardiovasculaire ziekte. (Zinman NEJM 2015, Wanner NEJM 2016. Inclusie eGFR > 30 ml/min/1.73m2, gemiddelde eGFR 74 ml/min/1.73m2).
CANVAS trial: Canaglifozine vs placebo resulteert in reductie primair cardiovasculair eindpunt (CV overlijden, ACS, CVA) (26,9 vs 31,5 events/1000 pt years, HR 0,86 (0,75-0,97)). Tevens reductie in renale eindpunten. (Neal NEJM 2017)
GLP1 agonisten:
LEADER trial: liraglutide vs placebo geeft reductie van primair cardiovasculair eindpunt (CV overlijden, ACS, CVA) (13 vs 14,9%, HR 0,87 (0,78-0,97)). Verder reductie van primair renaal eindpunt (new onset macroalbuminurie, verdubbeling serum creatinine, ESRD) (HR 0,78 (0,67-0,92). Bij een baseline eGFR tussen 30 en 60 ml/min/1.73m2 werd een significante vertraging in de achteruitgang van de eGFR gezien tijdens follow-up. (Marso NEJM 2016; 375:311-322. Mann NEJM 2017; studiepopulatie echter slechts 2.4% patiënten met eGFR < 30 ml/min/1.73m2).
SUSTAIN trial: semaglutide vs placebo geeft een reductie van het primair cardiovasculaire eindpunt (CV overlijden, ACS, CVA) (6,6 vs 8,9%, HR 0,74 (0,58-0,95)). (NEJM 2016; 375: 1834-44).
DPP4-remmers:
TECOS trial: sitagliptine vs placebo: geen effect op cardiovasculaire eindpunten, geen invloed op het beloop van de eGFR. (Cornel et al. Diabetes Care 2016. Green et al. NEJM 2015; inclusie: CKD 1-3b).
SAVOR-TIMI 53 trial: saxagliptine vs placebo heeft geen effect op cardiovasculair eindpunt (CV overlijden, ACS, CVA) (7,3 vs 7,1%, HR 1,00 (0,89-1,12)). Er wordt een geringe reductie gezien in de albumine-creatinine ratio in urine (34,3 mg/g, p< 0.001), echter geen verschil in harde renale eindpunten (eGFR, verdubbeling serum creatinine, start nierfunctievervanging) (2,2 vs 3,0%, HR 1,08 (0,88-1,32)), wel bij korte follow-up duur van 2 jaren. (Scirica et al, NEJM 2013.; Mosenzon et al. Diabetes Care 2016; Inclusie: eGFR< 30 ml/min: 2.1%; eGFR 30-50 ml/min: 13.6%)
Samenvattend:
|
Medicatie |
Trial |
Cardiovasculair effect |
Renaal effect |
Gebruik bij nierinsufficiëntie |
|
SGLT2-remmer |
EMPA-REG CANVAS |
Afname hartfalen, CV overlijden en ACS bij bekend AS CVD (nieuwe indicatie USA) |
Afname ontstaan en progressie DN |
Empagliflozine bij eGFR > 30 ml/min/1.73 m2 |
|
GLP1-agonist |
LEADER SUSTAIN |
Afname CV overlijden, ACS en CVA |
Afname ontstaan en progressie DN |
Bij elke nierfunctie Cave retinopathie |
|
DPP4-remmer |
TECOS SAVOR-TIMI-53 |
Geen effect op CV eindpunten |
Geen effect op DN (albuminurie?) |
Bij elke nierfunctie, met dosis-aanpassing |
CV: cardiovasculair; ACS: acuut coronair syndroom; AS CVD: atherosclerotic cardiovascular disease; DN: diabetische nefropathie
Ten aanzien van de vergoedingscriteria: DPP4-remmers, GLP1-antagonisten en SGLT2-remmers worden alleen vergoed indien metformin en/of SU derivaten niet worden verdragen of onvoldoende effectief zijn, en indien de patiënt geen insuline gebruikt. Daarnaast worden GLP1-antagonisten alleen vergoed bij een BMI > 35 kg/m2 of bij BMI > 30 kg/m2 indien behandeling middels basaal insuline en metformin gedurende minimaal 3 maanden onvoldoende effectief is.
Op grond van bovenstaande gegevens wordt het meewegen van de langetermijneffecten van diabetesmedicatie meer van belang, en lijkt de rol van m.n. SGLT2-remmers en GLP1-agonisten beter onderbouwd te worden. Bij de hernieuwde plaatsbepaling van de SGLT2-remmers en GLP1-agonisten in de behandeling van DM2 spelen echter ook andere factoren nog een rol, m.n. t.a.v. vergoeding en de hogere kosten van deze medicatie. De richtlijnencommissie heeft op grond van de huidige literatuurgegevens een concept behandelprotocol geformuleerd, weergegeven in onderstaande figuur, waarbij de rol van koolhydraatbeperkt dieet en bariatrische chirurgie nog niet is vastgesteld. In de multidisciplinaire richtlijn “diabetische nefropathie” (NIV/NfN), die naar verwachting medio 2019 zal uitkomen, zal de keuze tussen de verschillende diabetesmedicijnen en de rol van gewichtsreductie verder worden uitgewerkt.
Figuur: Behandelschema
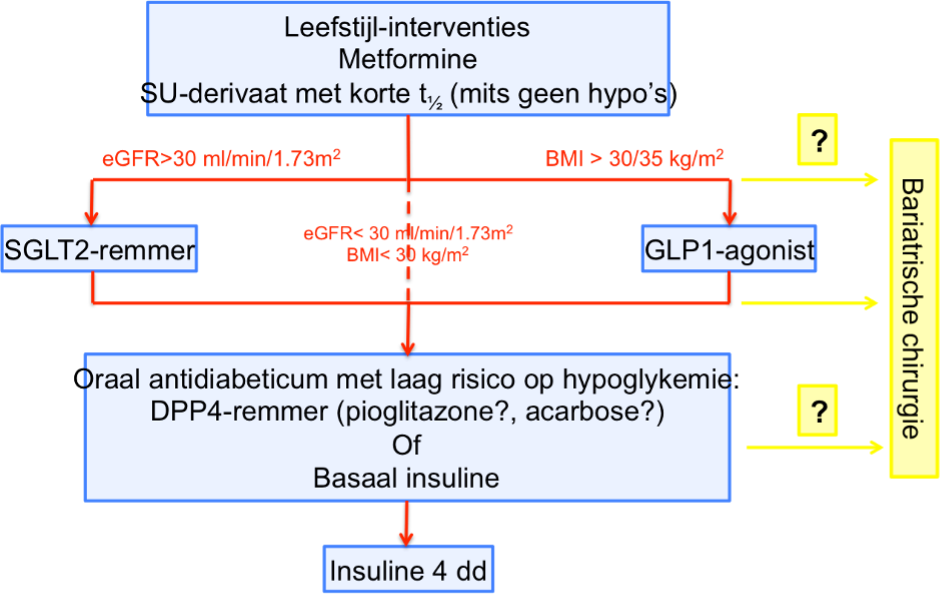
Conform de nieuwe richtlijn Veilig gebruik van contrastmiddelen, preventie post contrast-AKI wordt geadviseerd om bij een eGFR < 30 ml/min/1.73m2 gebruik van metformine tijdelijk te staken. Bij een eGFR tussen 30 en 45 ml/min/1.73m2 en laag risico op contrastschade is er geen noodzaak tot tijdelijk staken van metformin.
Statements
3.1.1 We recommend not omitting coronary angiography with the sole intention of avoiding potential contrast-related deterioration of kidney function in patients with diabetes and CKD stage 3b or higher (eGFR<45mL/min) in whom a coronary angiography is indicated (1D).
3.1.2 We recommend that optimal medical treatment should be considered as preferred treatment in patients with diabetes and CKD stage 3b–5 who have stable CAD, unless there are large areas of ischaemia or significant left main or proximal LAD lesions (1C).
3.1.3 We recommend that when a decision is taken to consider revascularization, CABG is preferred over PCI in patients with multivessel or complex (SYNTAX score >22) CAD (1C).
3.1.4 We recommend that patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min) who present with an acute coronary event should be treated no differently than patients with CKD stage 3b or higher (eGFR <45 mL/min) without diabetes or patients with diabetes without CKD stage 3b or higher (eGFR <45 mL/min) (1D).
Advice for clinical practice:
Commentaar van de Nederlandse Vereniging Voor Cardiologie (NVVC):
Bij de keuze voor CABG vs PCI spelen klinische, anatomische en logistieke factoren mee; de keuze wordt door het hartteam gemaakt. Verwijzing naar de European Society of Cardiology (ESC) richtlijn 2013:
The decision to use either PCI or CABG as preferred mode of revascularisation should be based on anatomical factors, together with clinical factors and other logistical or local factors. As a rule, PCI is recommended in diabetic patients with single vessel disease. Conversely, given the results of the FREEDOM trial, CABG is recommended in diabetic patients with multivessel disease, after discussion in a Heart Team meeting.
Statements
3.2.1 We recommend that adults with CKD stage 3b or higher (eGFR <45 mL/min/1.73 m2 or on dialysis) and diabetes who have a cardiovascular indication (heart failure, ischaemic heart disease) be treated with an ACE-I at maximally tolerated dose (1B).
3.2.2 We suggest there is insufficient evidence to justify the start of an angiotensin-receptor blocker (ARB) in adults with CKD stage 3b or higher (eGFR <45 mL/min/1.73 m2 or on dialysis) and diabetes who have a cardiovascular indication (heart failure, ischaemic heart disease) but intolerance for ACE-I (2B).
3.2.3 We recommend not combining different classes of renin angiotensin-blocking agents (ACE-I, ARBs or direct renin inhibitors) (1A).
Advice for clinical practice.
There is insufficient evidence whether or not RAAS inhibitors should be stopped in patients
with CKD progressing to CKD stage 5. A trial stopping the RAAS inhibitor with the aim to delay the need to start renal replacement therapy can be discussed with the patient.
Commentaar richtlijnencommissie:
De richtlijnencommissie merkt op dat de wetenschappelijke bewijskracht voor het effect van ARB’s bij patiënten met CKD3 en hoger en DM, op cardiovasculaire morbiditeit en mortaliteit en op renale uitkomsten, weliswaar beperkter is dan voor ACE-I, echter gezien de beschikbare wetenschappelijke gegevens en op theoretische gronden is een gunstig effect aannemelijk. Op grond hiervan gaat de voorkeur uit naar ACE-remmers, maar bij intolerantie hiervoor wordt wel aangeraden om een ARB voor te schrijven.
Er zijn geen RCT’s waarin het effect van staken van RAAS blokkade bij een eGFR < 30 ml/min/1.73m2 is onderzocht. Observationele data tonen na staken van RAAS blokkade een stijging van de eGFR. Op grond hiervan kan verlaging van de dosering of staken van de RAAS-blokkade worden overwogen in de predialyse fase.
Statements
3.3.1 We suggest starting a selective beta-blocking agent as primary prevention in patients with diabetes and CKD stage 3b or higher and then continuing it when tolerated (2C).
3.3.2 We suggest prescribing lipophilic rather than hydrophilic beta-blocking agents in patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min) (2C).
Verantwoording:
Acute hartdood is een belangrijke doodsoorzaak bij patiënten met CKD 3b en hoger en bij patiënten met DM. Hierbij spelen o.a. ventriculaire ritmestoornissen bij fibrose-ischemie en elektrolytstoornissen een rol. Bètablokkers kunnen effect hebben door de ventriculaire rate control en bij hartfalen. Een systematische review bij patiënten met DM toonde dat bij toevoeging van een bètablokker de overleving toenam. Hierbij is geen subgroepanalyse voor patiënten met verminderde nierfunctie verricht (Wu BMJ 2013). De CIBIS-studie is een RCT waarbij patiënten met hartfalen (ejectiefractie < 35%) behandeld werden middels bisoprolol of placebo. Bij gebruik van bisoprolol was er een afname in ziekenhuisopnames, een reductie in all-cause mortaliteit, en acuut overlijden (Erdman Eur J Heart Fail 2001).
Commentaar NVVC:
Er is, op grond van de CIBIS-studie, geen discussie over de vraag of een bètablokker bij verminderde LV-EF wordt geadviseerd ter vermindering van de kans op acute hartdood. Dit advies kan niet zonder meer worden geëxtrapoleerd naar patiënten met DM en CKD zonder verminderde LV-EF.
Aanvullend commentaar richtlijnencommissie:
De kans op hartfalen is bij deze patiëntenpopulatie met CKD3b of hoger en DM verhoogd. Hiermee moet rekening worden gehouden bij aanvullende diagnostiek.
Indien besloten wordt om een bètablokker voor te schrijven in het kader van hypertensiebehandeling dan wel bij vastgesteld hartfalen, adviseert de richtlijnencommissie om een lipofiele bètablokker voor te schrijven, gezien de kleinere kans op stapeling bij nierinsufficiëntie. Geadviseerd wordt om gebruik van hydrofiele bètablokkers atenolol, celiprolol en sotalol te beperken. Sotalol is een klasse III anti-arythmicum dat bij toxische dosering ernstige ventriculaire ritmestoornissen kan induceren.
Statements
3.4.1 We suggest against applying lower blood pressure targets in patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min/1.73 m2) than in the general population (2C).
3.4.2 We suggest that in patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min/1.73 m2) but without proteinuria, all blood pressure-lowering drugs can be used equally to lower blood pressure (2C).
Advice for clinical practice
Verantwoording:
In een Cochrane review werd behandeling van bloeddruk bij DM met streefwaarde < 130/85 mmHg vergeleken met een streefwaarde van 140-160/100 mmHg (Arguedas Cochrane 2013). De bereikte bloeddruk bedroeg resp. 119/64 vs 134/71 mm Hg. In de groep met de lagere streefwaarde werd een reductie van de incidentie van CVA gevonden, er was geen effect op mortaliteit, en er was een toename van het aantal ernstige bijwerkingen. 4 RCTs (geëvalueerd in een Cochrane review) onderzochten het effect van een lagere streefwaarde van de bloeddruk bij patiëntpatiënten met DM (bereikte bloeddruk 128/76 vs 135/85 mm Hg). Hierbij werd geen reductie gezien in totale mortaliteit, myocardinfarct en hartfalen. Ernstige bijwerkingen en gegevens over nierfunctie werden niet vermeld in deze studies (Estacio Am J Hypert 2006, Estacio Am J Card 1998, Schrier KI 2002, Cushman NEJM 2010, Hansson Lancet 1998).
Commentaar richtlijnencommissie:
De richtlijnencommissie merkt op dat bij evaluatie van het effect van bloeddrukregulatie door de ERBP m.n. het effect op de cardiovasculaire uitkomst is geëvalueerd, en niet het effect op de renale uitkomst. De richtlijnencommissie adviseert om conform de multidisciplinaire richtlijn “Chronische nierschade” te handelen. In de multidisciplinaire richtlijn “Chronische nierschade” (2017/2018) wordt geadviseerd om bij een eGFR < 60 ml/min/1.73 m2 een bloeddruk < 130/80 mmHg na te streven. Daarbij wordt aangeraden om het beleid te individualiseren, rekening houdend met comorbiditeit en leeftijd.
In de nieuwe multidisciplinaire richtlijn “Diabetische nefropathie” (verwacht medio 2019), zullen adviezen worden geformuleerd ten aanzien van het type antihypertensivum en de streefwaardes voor de bloeddruk bij preventie en behandeling van diabetische nefropathie.
Statements
3.5.1 We recommend starting a statin in patients with diabetes and CKD stage 3b and 4 (1B).
3.5.2 We suggest a statin be considered in patients with diabetes and CKD stage 5 (2C).
3.5.3 We recommend against starting a statin in patients with diabetes and CKD stage 5D (1A).
3.5.4 There was no consensus in the guideline development group on whether or not statins should be stopped in patients with diabetes with CKD stage 5D.
3.5.5 We suggest fibrates can replace statins in patients with CKD stage 3b who do not tolerate statins (2B). (Zie commentaar van de richtlijnencommissie)
Advice for clinical practice
Verantwoording:
De ERBP commissie baseert het behandeladvies op het ingeschatte risico op atherosclerotische cardiovascular disease. Gebaseerd op de AHA richtlijnen voor de algemene populatie, vormen de patiënten met DM een hoog-risico groep, met een geschat 10-jaars risico op AS-CVD > 10%. Bij CKD 3b of hoger is het aannemelijk dat het risico op AS-CVD aanzienlijk verhoogd is. Op grond hiervan is het risico op AS-CVD bij DM en CKD 3b of hoger waarschijnlijk > 10%, en wordt geadviseerd om te behandelen middels een statine. Dit advies geldt voor patiënten met CKD 3b en 4. Op grond van een subgroep-analyse van de SHARP studie bij CKD 5, waarbij een statine een niet-significante reductie van het risico op major vascular events gaf van 8%, wordt dit advies bij CKD 5 patiënten ter overweging gegeven (Castaneda Diab Care 2002). In de 4D studie werd geen effect gezien van behandeling middels statine bij dialysepatiënten (niet-significante 8% risico reductie op CV overlijden, niet-fataal myocardinfarct of CVA (Wanner NEJM 2005). Op grond hiervan wordt gebruik van statine bij CKD 5d niet aangeraden.
De ERBP commissie adviseert om behandeling met statine te starten op basis van het ingeschatte 10-jaars cardiovasculaire risico. Om deze reden wordt follow-up van het lipidengehalte niet geadviseerd. Dit is m.n. niet geïndiceerd als de maximale dosering (aangepast aan de nierfunctie) wordt voorgeschreven. Zie tabel 8
Table 8. Dose recommendations of statins in patients with CKD stage 3b or higher (eGFR <45 mL/min). Adapted from Tonelli and Wanner [Tonelli Ann Int Med 2014]. Statin Maximum dose when eGFR <45 mL/min
|
Statin |
Maximum dose when eGFR <45 ml/min |
|
Lovastatin |
No data |
|
Fluvostatin |
80 mg |
|
Atorvastatin |
20 mg |
|
Rosuvastatin |
10 mg |
|
Simvastatin/ezetimibe |
20/10 mg |
|
Pravastatin |
40 mg |
|
Simvastatin |
40 mg |
|
Pitavastatin |
2 mg |
Commentaar richtlijnencommissie:
T.a.v. stelling 3.5.5: De richtlijnencommissie merkt op dat er geen studies zijn die een verbetering op harde eindpunten tonen bij gebruik van een fibraat ter vervanging van een statine bij CKD 3b en hoger en DM, en is van oordeel dat een fibraat geen adequate vervanging is voor een statine bij intolerantie.
Statements
3.6.1 We suggest that patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min) perform additional physical exercise at least three times 1/2 to 1 hour/week to reduce fat mass and improve QoL (2D).
3.6.2 We suggest that there is no evidence of harm when promoting an individualized regimen of increased physical exercise (2C).
3.6.3 When promoting weight loss in patients with diabetes and with overweight, we recommend supervision of this process by a dietician and to ensure that only fat mass is lost and malnutrition is avoided (1C).
Verantwoording:
Er is weinig wetenschappelijke evidence voor de stelling dat gewichtsreductie bij patiënten met DM en CKD een gunstig effect heeft op harde eindpunten. Er is echter wel voldoende wetenschappelijke evidence dat toename van lichaamsbeweging en vermindering van de calorie-intake nuttig zijn voor verbetering van de diabetesregulatie, de BMI, de lichaamssamenstelling, de quality-of-life en het fysieke functioneren. Het is aannemelijk dat dit zal leiden tot een verbetering van de langetermijnprognose.
Statements
3.7.1 We recommend against adding glycoprotein IIb/IIIa inhibitors to standard care to reduce death, myocardial infarction, or need for coronary revascularization in patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min) and acute coronary syndromes (ACSs) or highrisk coronary artery intervention (1B).
3.7.2 We suggest not adding a thienopyridine or ticagrelor to standard care to reduce death, myocardial infarction, or need for coronary revascularization in patients with diabetes and CKD stage 3b or higher (eGFR <45 mL/min) and ACSs or high-risk coronary artery intervention unless there is no additional risk factor for bleeding (2B).
3.7.3 We recommend starting aspirin as secondary prevention, unless there is a contraindication, side effects or intolerance (1C).
3.7.4 We suggest starting aspirin as primary prevention only in patients without additional risk factors for major bleeding (2C).
Advice for clinical practice.
Consider clopidogrel as an alternative for aspirin in patients with clear intolerance or contraindications for aspirin.
Verantwoording:
Het formuleren van evidence based conclusies t.a.v. het gebruik van acetylsalicylzuur, glycoproteine IIb/III inhibitors (abciximab, eptifibatide, tirofiban), thienopyridines (clopidogrel, prasugrel, ticlopidine) en de P2Y12 remmer ticagrelor bij de behandeling, en primaire en secundaire preventie van cardiovasculaire aandoeningen bij CKD 3b en hoger en DM wordt bemoeilijkt door de beperkte wetenschappelijke data.
In een Cochrane review werd bewijs van lage kwaliteit gevonden dat bij patiënten met CKD 3b en DM bij een acuut coronair syndroom een behandeling bestaande uit glycoproteine IIb/III remmers of clopidogrel naast standaard zorg vs alleen standaard zorg, geen verbetering van all-cause of cardiovasculaire mortaliteit gaf, maar wel een toename van ernstige bloedingen (Palmer Ann Int Med 2012). In deze review werd verder bij patiënten zonder preëxistente cardiovasculaire aandoeningen of met stabiele CV aandoeningen wel gevonden dat antiplatelet therapie de kans op een ACS verminderde, maar er was geen duidelijk effect op mortaliteit en de kans op een minor bloeding was verhoogd.
In de CHARISMA trial (Dasgupta Am J Card 2009) was bij patiënten met DM type II met diabetische nefropathie de mortaliteit (all-cause en cardiovasculair) verhoogd bij gebruik van dual antiplatelet therapie (clopidogrel en aspirine) vs alleen aspirine.
In de JPAD trial (Nakamura Diab Metab 2005) resulteerde gebruik van aspirine (vs placebo) bij patiënten met DM type II in een reductie van de cardiovasculaire morbiditeit en mortaliteit bij patiënten met een eGFR > 60 ml/min/1.73m2, maar niet bij patiënten met een eGFR < 60 ml/min/1.73m2.
In de PLATO studie (James Stroke 2013) bij patiënten met een ACS bleek bij patiënten met een eGFR < 60 ml/min/1.73m2ticagrelor een reductie te geven van mortaliteit en cardiovasculaire eindpunten, vergeleken met clopidogrel. In de CREDO en CURE studie (Fox Circ 2004, Best Am Heart J 2008) was gebruik van clopidogrel vs placebo bij patiënten met een eGFR < 60 ml/min/1.73m2 geassocieerd met een niet–significante slechtere outcome. Er is geen RCT waarin ticagrelor wordt vergeleken met placebo.
In een systematische review (Calvin Diab Care 2009) werd gevonden dat gebruik van aspirine bij patiënten met DM en CKD 3b of hoger geassocieerd is met een niet-significante afname van ACS en CVA.
Standaard of gecombineerde antiplatelet therapie bij CKD is geassocieerd met een toename in bloedingsrisico (Palmer Ann Int Med 2012). In de UK-HARP trial (Baigent AJKD 2005) werd bij gebruik van aspirine bij CKD patiënten t.o.v. placebo een toename gezien van minor bloedingen, maar niet van major bloedingen.
Commentaar NVVC:
T.a.v. stellling 3.7.1: GP IIb/IIIa remmers worden alleen gebruikt rondom een interventie waarbij de interventiecardioloog daar een indicatie voor ziet (bv in geval van no-reflow). Deze indicatie geldt dan in principe ook bij een patiënt met DM en CKD. Hierbij wordt wel rekening gehouden met specifieke contra-indicaties en doseringsadviezen gerelateerd aan de nierfunctie.
T.a.v. stelling 3.7.2: Ook bij patiënten met DM en een eGFR< 45 ml/min is er bij een ACS indicatie voor DAPT, zeker rondom een interventie met een stent. Bij een hoog bloedingsrisico kan i.p.v. ticagrelor evt clopidogrel worden overwogen.
Verwijzing naar de ESC richtlijn over non-stemi uit 2016 (Roffi Eur Heart J 2016): It is recommended to administer the same antithrombotic treatment in diabetic and non-diabetic patients (1C). (pag 301).
It is recommended to administer the same first-line antithrombotic treatment as in patients with normal kidney function, with appropriate dose adjustment if indicated (1B). (pag 302).
T.a.v. stelling 3.7.4: aspirine als primaire preventie is discutabel.
Richtlijn ADA 2017: Het risico op een major bloeding bij gebruik van acetylsalicylzuur is 1-5 events/1000 pt jr. Hiermee rekening houdend wordt het gebruik van acetylsalicylzuur als primaire preventie zinvol geacht als de kans op AS-CVD hoger is dan 1% in 1 jaar. Op grond hiervan wordt het advies gegeven om acetylsalicylzuur als primaire preventie te overwegen bij DM I/II, leeftijd boven 50 jaar en 1 extra risicofactor (familiair verhoogd risico, hyperlipidemie, roken, albuminurie / nierinsufficiëntie) (C).
Opmerking richtlijnencommissie:
Gebruik van acetylsalicylzuur als primaire preventie voor cardiovasculaire aandoeningen bij DM en CKD blijft controversieel. Bij het inschatten van het bloedingsrisico in de richtlijn van de ADA is uitgegaan van patiënten met DM, geen rekening houdend met de nierfunctie. Recente studies bij patiënten met respectievelijk DM en CKD laten geen gunstig effect zien van acetylsalicylzuur bij de primaire preventie van cardiovasculaire aandoeningen, maar wel een toename van (gastro-intestinale) bloedingen (Saito Circulation 2017, Major Atherosclerosis 2016).
© 2022. Alle rechten voorbehouden