Hepatitis C preventie, diagnose en behandeling bij chronische nierschade
Autorisatiedatum: 26-08-2024
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
KDIGO 2022 clinical practice guideline for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van een goede zorg voor de patiënt, van een richtlijn moet worden afgeweken
Verantwoordelijk lid van de NFN richtlijnencommissie:
Geen belangenverstrengeling
|
AL(A)T |
alanine aminotransferase |
|
CKD |
chronic kidney disease |
|
DAA |
direct werkende antivirale middelen |
|
HBcAg |
hepatitis B core antigen |
|
HBsAg` |
hepatitis B surface antigen |
|
HBV |
hepatitis B virus |
|
HCV |
hepatitis C virus |
|
HIV |
humaan immunodeficiëntievirus |
|
KDIGO |
Kidney Disease Improving Global outcomes |
|
LONT |
Landelijk Overleg Nier Transplantatie |
|
MSM |
mannen die seks hebben met mannen |
|
NAT |
nucleic acid test (polymerase chain reaction; PCR) |
|
NFN |
Nederlandse Federatie voor Nefrologie |
Deze richtlijn behandelt de preventie, diagnostiek en behandeling van hepatitis C virus (HCV) infectie bij patiënten met chronische nierinsufficiëntie, niertransplantatiepatiënten en HCV gerelateerde nierziekte. Voor adviezen ten aanzien van niertransplantaties met anti-HCV positieve postmortale nierdonoren verwijzen wij naar de LONT richtlijn “niertransplantatie met een anti-HCV positieve postmortale nierdonor”.
De richtlijn bevat de adviezen van de in 2022 herziene KDIGO (Kidney Disease Improving Global Outcomes) guideline met commentaar en adviezen van de richtlijnencommissie relevant voor de Nederlandse praktijk [1].
Sinds het verschijnen van de eerste KDIGO guideline in 2008 is er veel veranderd in de behandeling van HCV. Sinds 2014 zijn nieuwe direct werkende antivirale middelen (DAA’s) beschikbaar in Nederland. Behandeling met DAA’s is zeer effectief waarbij de kans op genezing >95% is. De geschatte HCV prevalentie in Nederland neemt hierdoor sterk af [2]. De beschikbaarheid van een effectieve behandelstrategie heeft er ook toe geleid dat niertransplantaties met anti-HCV positieve donoren mogelijk worden geacht, mits goede surveillance en eventuele DAA behandeling na transplantatie beschikbaar is.
KDIGO gebruikt naast GRADE systematiek voor aanbevelingen op basis van beschikbare evidence (1 A-D voor recommendations en 2 A-D voor suggestions) ook practice points op basis van expert opinion. Deze aanbevelingen en practice points zijn in deze NFN richtlijn ongewijzigd in het Engels vetgedrukt overgenomen en vervolgens waar nodig voorzien van commentaar voor de Nederlandse situatie
1.1.1: We recommend screening all patients for HCV infection at the time of initial evaluation of CKD (1C).
1.1.1.1: We recommend using an immunoassay followed by nucleic acid testing (NAT) if immunoassay is positive (1A).
1.1.2: We recommend screening all patients for HCV infection upon initiation of in-center hemodialysis or upon transfer from another dialysis facility or modality (1A).
1.1.2.1: We recommend using NAT alone or an immunoassay followed by NAT if immunoassay is positive (1A).
1.1.3: We suggest screening all patients for HCV infection upon initiation of peritoneal dialysis or home hemodialysis (2D).
1.1.4: We recommend screening all patients for HCV infection at the time of evaluation for kidney transplantation (1A).
Commentaar:
De geschatte prevalentie van HCV-antistoffen in de Nederlands bevolking is 0,06-0,27% en is relatief laag in vergelijking met andere landen [3, 4]. Daarom adviseren wij om CKD patiënten niet standaard te screenen op HCV zoals wordt aanbevolen in de KDIGO richtlijn. Wij adviseren om alleen de volgende CKD patiënten met een hoog risico op HCV te screenen:
Daarnaast wel standaard screening bij (pre)dialyse patiënten, pretransplantatiepatiënten en patiënten met een glomerulonefritis zonder classificerende diagnose.
Vanwege de lage prevalentie van HCV-infectie in Nederland, volstaat een immunoassay (antistoffen) als screenende test conform de KDIGO richtlijn, tenzij een eventuele besmetting kort geleden kan hebben plaatsgevonden zoals bij patiënten die hebben gedialyseerd in een endemisch gebied. In dat geval kunnen HCV-antistoffen (immuno-assay) nog negatief zijn en is een NAT-test (PCR) geïndiceerd.
NFN advies:
HCV screening is geïndiceerd bij CKD patiënten met een hoog risico op HCV, (pre)dialyse patiënten, pretransplantatiepatiënten en patiënten met een glomerulonefritis zonder classificerende diagnose.
1.2.1: We recommend screening for HCV infection with immunoassay or NAT in in-center hemodialysis patients every 6 months (1B).
1.2.1.1: Report any new HCV infection identified in a hemodialysis patient to the appropriate public health authority (Not Graded).
1.2.1.2: In units with a new HCV infection, we recommend that all patients be tested for HCV infection and that the frequency of subsequent HCV testing be increased (1A).
1.2.1.3: We recommend that hemodialysis patients with resolved HCV infection undergo repeat testing every 6 months using NAT to detect possible re-infection (1B).
1.2.2: We suggest that patients have serum alanine aminotransferase (ALT) level checked upon initiation of in-center hemodialysis or upon transfer from another facility (2B).
1.2.2.1: We suggest that hemodialysis patients have ALT level checked monthly (2B).
Commentaar
Vanwege de relatief lage HCV-infectie prevalentie in Nederland, adviseren wij om bij hemodialysepatiënten eenmaal per jaar HCV-antistoffen en eenmaal per zes maanden leverenzymen te bepalen conform de NfN Richtlijn “laboratoriumbepalingen en periodiek onderzoek bij stabiele chronische hemodialyse en peritoneale dialyse patiënten” [5]. In dialysecentra waar HCV positieve patiënten en/of hoogrisico patiënten dialyseren, adviseren wij echter om maandelijks het ALAT te meten bij alle dialysepatiënten, vanwege de kans op iatrogene transmissie [6]. Een tijdelijke ALAT stijging bij een nieuwe HCV infectie kan gemist worden indien slechts eenmaal per zes maanden een ALAT zou worden gecontroleerd.
NFN adviezen:
1.3.1: We recommend assessing HCV-infected patients with CKD for liver fibrosis (1A).
1.3.2: We recommend an initial noninvasive evaluation of liver fibrosis (1B).
1.3.3: When the cause of liver disease is uncertain or noninvasive testing results are discordant, consider liver biopsy (Not Graded).
1.3.4: We recommend assessment for portal hypertension in CKD patients with suspected advanced fibrosis (F3–4) (1A).
NFN advies:
Verwijs HCV-positieve patiënten naar de MDL arts voor analyse van leverfibrose.
1.4.1: We recommend assessing all patients for kidney disease at the time of HCV infection diagnosis (1A).
1.4.1.1: Screen for kidney disease with urinalysis and estimated glomerular filtration rate (eGFR) (Not Graded).
1.4.2: If there is no evidence of kidney disease at initial evaluation, patients who remain NAT-positive should undergo repeat screening for kidney disease (Not Graded).
1.4.3: We recommend that all CKD patients with a history of HCV infection, whether NAT-positive or not, be followed up regularly to assess for progression of kidney disease (1A).
1.4.4: We recommend that all CKD patients with a history of HCV infection, whether NAT-positive or not, be screened and, if appropriate, vaccinated against hepatitis A virus (HAV) and hepatitis B virus (HBV), and screened for human immunodeficiency virus (HIV) (1A).
Commentaar
In de richtlijn voor MDL artsen is opgenomen dat nierfunctie gecontroleerd moet worden bij een nieuwe HCV infectie.
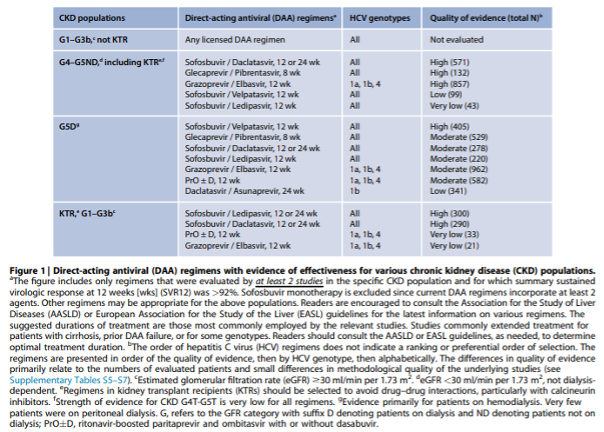
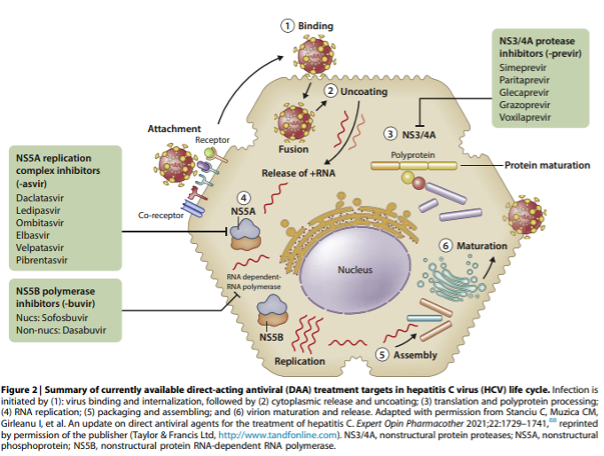
2.1: We recommend that all patients with CKD (G1-G5), on dialysis (G5D), and kidney transplant recipients (G1T-G5T) with HCV be evaluated for direct-acting antiviral (DAA)-based therapy as outlined in Figure 1 (1A).
2.1.1: We recommend that the choice of specific regimen be based on prior treatment history, drug–drug interactions, GFR, stage of hepatic fibrosis, kidney and liver transplant candidacy, and comorbidities (1A). If pangenotypic regimens are not available, HCV genotype (and subtype) should guide the choice of treatment (Figure 1).
2.1.2: Treat kidney transplant candidates in collaboration with the transplant center to optimize timing of therapy (Not Graded).
2.1.3: We recommend pre-treatment assessment for drug–drug interactions between the DAA-based regimen and other concomitant medications including immunosuppressive drugs in kidney transplant recipients (1A).
2.1.4: We recommend that calcineurin inhibitor levels be monitored during and after DAA treatment in kidney transplant recipients (1B).
2.2: All patients with CKD (G1-G5), on dialysis (G5D), and kidney transplant recipients (G1T-G5T) with HCV should undergo testing for hepatitis B virus (HBV) infection prior to DAA therapy (Not Graded).
2.2.1: If hepatitis B surface antigen [HBsAg] is present, the patient should undergo assessment for HBV therapy (Not Graded).
2.2.2: If HBsAg is absent but markers of prior HBV infection (HBcAb-positive with or without HBsAb) are detected, exclude HBV reactivation with HBV DNA testing if levels of liver function tests rise during DAA therapy (Not Graded).
NFN advies:
3.1: We recommend that hemodialysis facilities adhere to standard infection control procedures including hygienic precautions that effectively prevent transfer of blood and blood-contaminated fluids between patients to prevent transmission of blood-borne pathogens (see Table 1) (1A).
|
Table 1 | Infection control practices (“hygienic precautions”) particularly relevant for preventing HCV transmission |
|
3.1.1: We recommend regular observational audits of infection control procedures in hemodialysis units (1C).
3.1.2: We recommend not using dedicated dialysis machines for HCV-infected patients (1D).
3.1.3: We suggest not isolating HCV-infected hemodialysis patients (2C).
3.1.4: We suggest that the dialyzers of HCV-infected patients can be reused if there is adherence to standard infection control procedures (2D).
3.2: We recommend that hemodialysis centers examine and track all HCV test results to identify new cases of HCV infections in their patients (1B).
3.2.1: We recommend that aggressive measures be taken to improve hand hygiene (and proper glove use), injection safety, and environmental cleaning and disinfection when a new case of HCV is identified that is likely to be dialysis-related (1A).
3.3: Strategies to prevent HCV transmission within hemodialysis units should prioritize adherence to standard infection control practices and should not primarily rely upon the treatment of HCV-infected patients (Not Graded).
Table 3 | Factors and lapses in infection control practices associated with transmission of HCV infection in dialysis units




Commentaar
Ter preventie van de verspreiding van HCV dienen de juiste methoden en producten te worden toegepast zoals beschreven in de multidisciplinaire richtlijn ‘Hemodialyse’ van Samenwerkingsverband Richtlijnen en Infectiepreventie (SRI), die in najaar 2024 zal verschijnen.
4.1.1: We recommend kidney transplantation as the best therapeutic option for patients with CKD G5 irrespective of presence of HCV infection (1A).
Commentaar
De keuze voor het starten van nierfunctievervangende therapie en welke vorm (dialyse of niertransplantatie, komt tot stand middels gedeelde besluitvorming en dient niet beïnvloed te worden door de aan- of afwezigheid van een HCV infectie [7].
4.1.2: We suggest that all kidney transplant candidates with HCV be evaluated for severity of liver disease and presence of portal hypertension prior to acceptance for kidney transplantation (2D).
4.1.2.1: We recommend that patients with HCV, compensated cirrhosis, and no portal hypertension undergo isolated kidney transplantation and that patients with decompensated cirrhosis or clinically significant portal hypertension (i.e., hepatic venous pressure gradient ≥10 mm Hg or evidence of portal hypertension on imaging or exam) undergo a simultaneous liver–kidney transplantation (1B). Treatment of those with mild-to-moderate portal hypertension should be determined on a case-by-case basis.
4.1.2.2: We recommend referring patients with HCV and decompensated cirrhosis for combined liver–kidney transplantation (1B).
4.1.3: Timing of HCV treatment in relation to kidney transplantation (before vs. after) should be based on donor type (living vs. deceased donor), wait-list times by donor type, center-specific policies governing the use of kidneys from HCV-infected deceased donors, and severity of liver fibrosis (Not Graded).
4.1.3.1: We recommend that all kidney transplant candidates with HCV be considered for DAA therapy, either before or after transplantation (1A).
4.1.3.2: We suggest that HCV-infected kidney transplant candidates with a living kidney donor be considered for treatment before or shortly after transplantation depending on the anticipated timing of transplantation (2B).
Commentaar
Geen aanvullingen voor Nederlandse situatie.
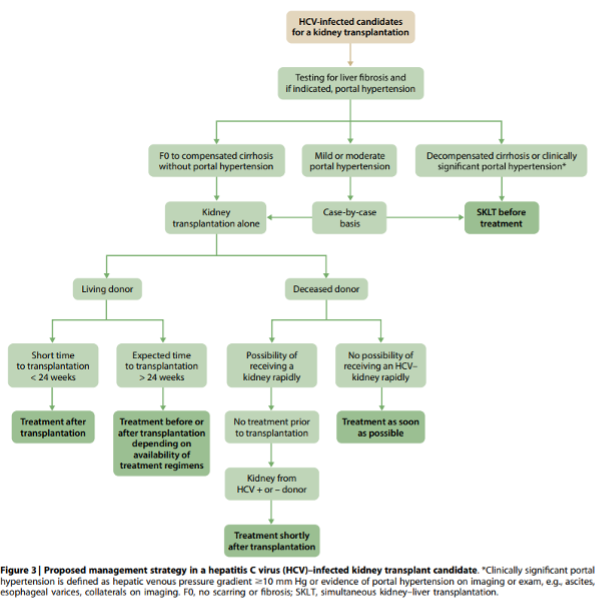
4.2.1: We recommend that all kidney donors be screened for HCV infection with both immunoassay and NAT (if NAT is available) (1A).
4.2.2: After assessment of liver fibrosis, HCV-infected potential living kidney donors who do not have cirrhosis should undergo HCV treatment before donation if the recipient is HCV-uninfected; they can be accepted for donation if they achieve sustained virologic response (SVR) and remain otherwise eligible to be a donor (Not Graded).
4.2.3: We recommend that kidneys from HCV-infected donors be considered regardless of HCV status of potential kidney transplant recipients (1C).
4.2.4: When transplanting kidneys from HCV-infected donors into HCV-uninfected recipients, transplant centers must ensure that patients receive education and are engaged in discussion with sufficient information to provide informed consent. Patients should be informed of the risks and benefits of transplantation with an HCV infected kidney, including the need for DAA treatment (Not Graded).
4.2.5: When transplanting kidneys from HCV-infected donors into HCV-uninfected recipients, transplant centers should confirm availability of DAAs for initiation in the early post-transplant period (Not Graded).
Commentaar:
Beleid ten aanzien van HCV positieve donoren wordt bepaald door de transplantatiecentra en zal in nabije toekomst vastgelegd worden in “LONT richtlijn niertransplantatie met een anti-HCV positieve postmortale nierdonor”.
4.3.1: We recommend that kidney transplant recipients being treated with DAAs be evaluated for the need for dose adjustments of concomitant immunosuppressants (1C).
Commentaar:
Beleid ten aanzien van HCV positieve donoren wordt bepaald door de transplantatiecentra en zal in nabije toekomst vastgelegd worden in “LONT richtlijn niertransplantatie met een anti-HCV positieve postmortale nierdonor”.
4.4.1: We suggest that patients previously infected with HCV who achieved SVR before transplantation undergo testing by NAT 3 months after transplantation or if liver dysfunction occurs (2D).
4.4.2: Kidney transplant recipients with cirrhosis should have the same liver disease follow-up as non-transplant patients, as outlined in the American Association for the Study of Liver Diseases (AASLD) guidelines (Not Graded).
4.4.3: HCV-infected kidney transplant recipients should be tested at least every 6 months for proteinuria (Not Graded).
4.4.3.1: We suggest that patients who develop new-onset proteinuria (either urine protein-creatinine ratio > 1 g/g or 24-hour urine protein > 1 g on 2 or more occasions) have an allograft biopsy with immunofluorescence and electron microscopy included in the analysis (2D).
4.4.4: We recommend treatment with a DAA regimen in patients with post-transplant HCV-associated glomerulonephritis (1D).
Commentaar
HCV patiënten komen altijd in aanmerking voor behandeling, ongeacht de aanwezigheid van een HCV-geassocieerde nierziekte.
5.1: HCV-infected patients with a typical presentation of immune-complex proliferative glomerulonephritis can be managed without a confirmatory kidney biopsy. However, a biopsy may be indicated in certain clinical circumstances (Figure 4) (Not Graded).
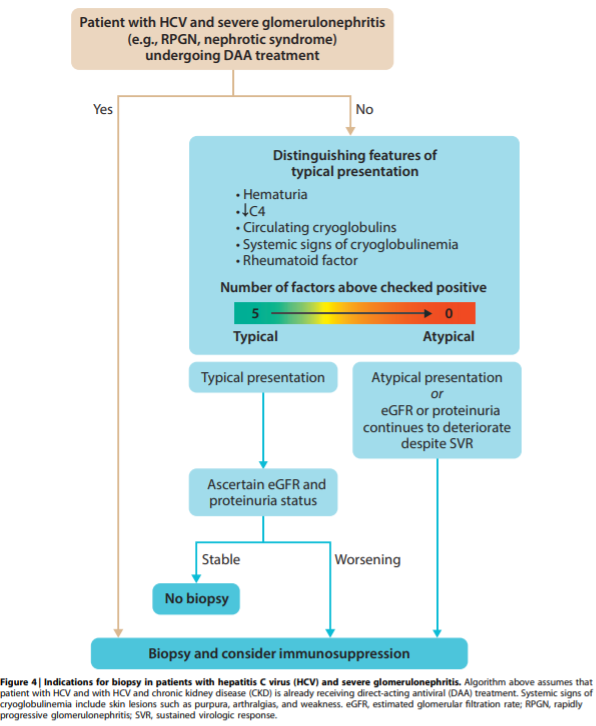
5.2: We recommend that patients with HCV-associated glomerulonephritis receive antiviral therapy (1A).
5.2.1: We recommend that patients with HCV-associated glomerulonephritis, stable kidney function, and without nephrotic syndrome be treated with DAAs prior to other treatments (1C).
5.2.2: We recommend that patients with cryoglobulinemic flare or rapidly progressive glomerulonephritis be treated with both DAAs and immunosuppressive agents with or without plasma exchange (1C).
5.2.2.1: The decision whether to use immunosuppressive agents in patients with nephrotic syndrome should be individualized (Not Graded).
5.2.3: We recommend immunosuppressive therapy in patients with histologically active HCV-associated glomerulonephritis who do not respond to antiviral therapy, particularly those with cryoglobulinemic kidney disease (1B).
5.2.3.1: We recommend rituximab as the first-line immunosuppressive treatment (1C).
Commentaar
Geen aanvullingen voor de Nederlandse situatie.
1. Kidney Disease: Improving Global Outcomes Hepatitis, C.W.G., KDIGO 2022 Clinical Practice Guideline FOR the Prevention, Diagnosis, Evaluation, and Treatment of Hepatitis C in Chronic Kidney Disease. Kidney Int, 2022. 102(6S): p. S129-S205.
2. van Dijk, M., et al., The Netherlands Is on Track to Meet the World Health Organization Hepatitis C Elimination Targets by 2030. J Clin Med, 2021. 10(19).
3. LCI guidelines hepatitis C. July, 2019. Accessed June 11, 2024. https://lci.rivm.nl/richtlijnen/hepatitis-c.
4. Koopsen, J., et al., Chronic hepatitis B and C infections in the Netherlands: estimated prevalence in risk groups and the general population. Epidemiol Infect, 2019. 147: p. e147.
5. NFN guidelines: Laboratoriumbepalingen en periodiek onderzoek bij stabiele dialysepatiënten, 2016. Accessed August 17, 2024. https://www.nefro.nl/sites/www.nefro.nl/files/richlijnen/Laboratoriumbepalingen%20en%20periodiek%20onderzoek%20dialysepatienten%2C%202016.pdf.
6. Schneeberger, P.M., et al., The prevalence and incidence of hepatitis C virus infections among dialysis patients in the Netherlands: a nationwide prospective study. J Infect Dis, 2000. 182(5): p. 1291-9.
7. NIV Guidelines. Nierfunctie vervangende behandeling. Accessed August 17, 2024. https://richtlijnendatabase.nl/richtlijn/nierfunctievervangende_behandeling/nierfunctievervangende_behandeling_-_startpagina.html.
© 2022. Alle rechten voorbehouden