Terug naar het richtlijnenoverzicht
Deze richtlijn behandelt de diagnostiek en therapie van IgA-nefropathie (IgAN) en IgA vasculitis.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van een goede zorg voor de patiënt, van een richtlijn moet worden afgeweken.
De werkgroep die deze richtlijn heeft ontwikkeld, had als opdracht om de aanbevelingen uit het hoofdstuk over IgAN uit de KDIGO richtlijn 2021 getiteld ‘Clinical Practice Guideline for the Management of Glomerular Diseases’, aan te vullen met gegevens die sinds 2021 zijn verschenen en te voorzien van commentaar gericht op de Nederlandse situatie. Deze richtlijn vervangt de IgA richtlijn van de NFN uit 2013.
De richtlijn is bedoeld voor internist-nefrologen en kinderartsen die patiënten met IgAN en IgA vasculitis behandelen.
Verantwoordelijk lid van de NFN richtlijnencommissie: Dr. J. van der Leeuw
Geen belangenverstrengeling
Nederlandse NFN richtlijn is als volgt opgebouwd:
Lijst met afkortingen:
ACR albumin creatinineratio
AKI Acute kidney injury
CNS Chronische nierschade
EKR eiwit kreatinineratio
IgAN IgA nefropathie
MRA Mineralocorticoid receptor antagonist
MMF Mycofenolaatmofetil
PCR protein creatinineratio
RPGN Rapidly progressive glomerulonephritis
SGLT-2 Sodium glucose co-transporter-2
De richtlijn wordt gepubliceerd op de website van de NFN, www.nefro.nl en is ook via de website van Nefrovisie te bereiken, www.nefrovisie.nl.
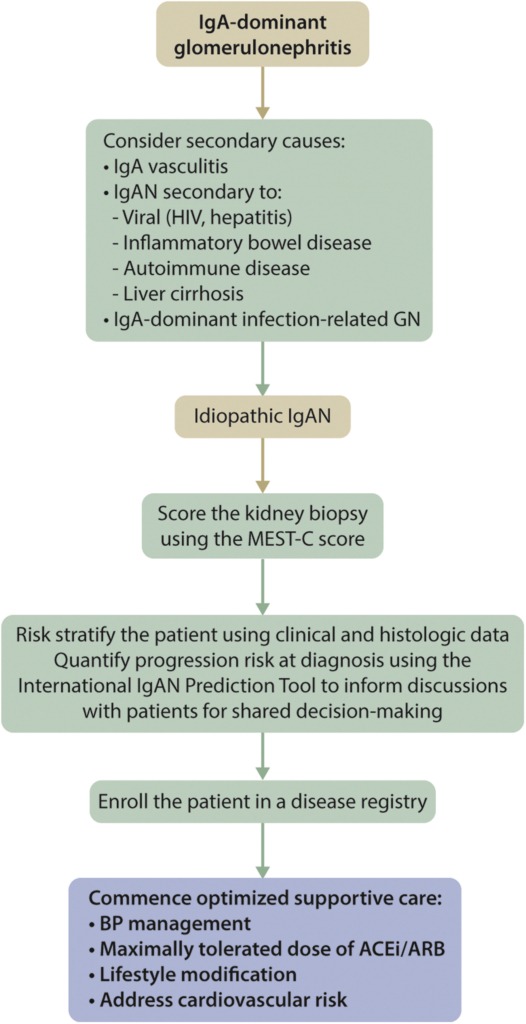
Practice Point 2.1.1: Considerations for the diagnosis of immunoglobulin A nephropathy (IgAN):
Commentaar
Er is grote interobserver variabiliteit bij het bepalen van de MEST-C score. Reproduceerbaarheid tussen enerzijds twee pathologen die betrokken waren bij de studies waarin de score is ontwikkeld en anderzijds lokale pathologen was ‘moderate’ voor S en T en ‘poor’ voor M, E en C. (2)
De MEST-C score is niet geschikt voor het maken van behandelkeuzes.
Practice Point 2.2.1: Considerations for the prognostication of primary IgAN:
[1] Although the models can generate predicted risks at any time point after biopsy, we suggest using 5 years and no more than 7 years because these are the 50th and 75th percentiles of follow-up duration. This time horizon should be considered in the context of a lifelong, slowly progressive disease. Finally, the prediction models were designed to be applied near the time of biopsy, and additional research is needed to determine if they can be used at other time points in the trajectory of the disease.
Onderbouwing
De International IgAN Prediction Tool is een risicovoorspellingsmodel voor IgAN waarin klinische data en histologische data (Oxford MEST score) op het moment van het nierbiopt gebruikt worden om het risico op 50% reductie in eGFR of het ontwikkelen van eindstadium nierfalen in de komende 5 jaar te kunnen voorspellen.
Commentaar
Aandachtspunten bij het gebruik van de risicomodellen:
De links naar de tools zijn te vinden op QxMD:
Practice Point 2.3.1: Considerations for treatment of all patients with IgAN who do not have a variant form of primary IgAN:
|
Recommendation 2.3.1: We recommend that all patients have their blood pressure managed, as described in Chapter 1. If the patient has proteinuria >0.5 g/d, we recommend that initial therapy be with either an angiotensin-converting enzyme inhibitor (ACEi) or angiotensin II receptor blocker (ARB) (1B). |
Commentaar
Voor algemene adviezen voor patiënten met glomerulonefritis verwijzen we naar de NFN richtlijn ‘Glomerulonefritis hoofdstuk 1 algemene principes en behandeling’.
|
Recommendation 2.3.2: We recommend that all patients with proteinuria >0.5 g/d, irrespective of whether they have hypertension, be treated with either an ACEi or ARB (1B). |
Onderbouwing
IgAN heeft een doorgaans langzaam progressief beloop waarbij conservatieve behandeling met bloeddruk regulatie en proteïnurie reductie centraal staan. Recente observationele data tonen, ook bij patiënten met proteïnurie van <0.5g/d die traditioneel als laag risico werden beschouwd, een verhoogd risico op nierfunctieverlies(3). Conservatieve interventies verminderen progressie van nierfunctieverlies bij patiënten met chronische nierschade in het algemeen en mogelijk in sterkere mate bij IgAN. ACEi en ARBs zijn de middelen van eerste keus vanwege aangetoonde meerwaarde in vermindering van nierfunctieverlies ook wanneer de streefbloeddruk reeds bereikt is. Duale RAS inhibitie heeft geen meerwaarde.
SGLT2-remmers
Recent onderzoek toont het nut van SLGT2-remmers als nieuwe ondersteunende behandeling bij chronische nierschade (CNS) om zowel het cardiovasculaire als renale risico te verlagen. In een subgroep analyse van de DAPA-CKD studie verminderde dapaglifozine de achteruitgang van nierfunctie in een grote groep patiënten met IgAN.(4) Deelnemers met een eGFR tussen 25-75ml/min/1.73m2 en ACR van 23-565mg/mmol kregen dapaglifozine 10mg naast standaardtherapie. In de groep van 270 deelnemers met IgAN (waarvan 94% biopt bewezen) was er 11% reductie van de primaire uitkomst (eGFR afname >50%, nierfalen of renale of cardiovasculaire dood) bij een mediane follow up van 2.1 jaar (HR 0.29 95%CI 0.12-0.73). De ACR nam af met 26%. Het bijwerkingenprofiel was vergelijkbaar tussen de interventiegroep en placebo. Er was specifiek geen toename van ketoacidose, ernstige hypoglycemie of volumedepletie Kanttekening is dat dit geen specifieke IgAN studie was en onduidelijk is of RAS inhibitie (en andere conservatieve maatregelen) vooraf was gemaximaliseerd. Een andere kanttekening is het bovengemiddelde aandeel van patiënten (bijna een kwart) in de placebogroep dat het eindpunt van 50% eGFR verlies of nierfalen bereikte.(5) In de EMPA-CKD studie had een kwart van de deelnemers een glomerulonephritis als grondlijden, maar een specifieke gedetailleerde subgroep analyse is nog niet gepubliceerd(6) Uit een meta-analyse van Baigent et al. is wel al af te leiden dat bij 413 patiënten met IgAN het relatieve risico 0.49 (95% 0.32 – 0.74) is ten opzichte van placebo.(7)
Mineralocorticoïd receptor antagonisten
Daarnaast hebben de klassieke steroïdale mineralocorticoïd receptoren antagonisten (MRA), zoals spironolacton en eplerenone en de nieuwe nonsteroïdale MRA finerenone, de potentie om proteïnurie te reduceren.(8) In een recente grote gerandomiseerde studie (FIDELIO-DKD) bij 5734 patiënten met type 2 diabetes en een eGFR tussen 25-75ml/min/1.73m2 en ACR van 23 – 565 mg/mmol, werd finerenone toegevoegd aan maximaal verdraagbare dosis ACEi/ARB.(9) Het primaire eindpunt (eGFR afname >40%, nierfalen of renale dood) nam met 18% af in een periode van 2.6 jaar (HR 0.82; 95%CI 0.73-0.93). Op basis van deze en een cardiovasculaire uitkomsten studie (FIGARO-DKD) heeft finerenone als nonsteroïdale MRA een plek gekregen in de KDIGO 2022 Diabetes in CNS richtlijn. Er ontbreekt vooralsnog specifiek onderzoek bij IgAN.
Duale angiotensine en endotheline antagonisten
Een andere ontwikkeling op niet-immunologisch gebied betreft het medicijn sparsentan. Dit middel is een duale endotheline en angiotensine receptor antagonist. Recent onderzoek wijst op een rol van endotheline-1 in de pathofysiologie van IgAN. In de PROTECT-studie wordt monotherapie sparsentan vergeleken met irbesartan in 406 patiënten met biopt bewezen IgAN, een eGFR 30ml/min en >1 gram proteïnurie per dag ondanks maximale RAS inhibitie.(10) Het primaire eindpunt is reductie in proteïnurie. Uit de interim analyse blijkt dat sparsentan 400mg 1dd1 na 36 weken een aanvullende afname in proteïnurie geeft van 41% (95%CI 0.51-0.69). Het bijwerkingenprofiel was vergelijkbaar met irbesartan.(11) Recente langere termijn data van deze studie toont daarbij een significant langzamere daling van de eGFR gedurende 2 jaar van -2.7 ml/min/1.73m2 versus 3.8 ml/min per jaar (tussen week 6 en 110). Ook het effect op reductie in proteïnurie bleef behouden en was na 110 weken 40% lager met sparsentan (95%CI 38 – 50). Het samengestelde eindpunt van nierfalen was 4% lager met een relatief risico van 0.7 (95%CI 0.4 – 1.2). Sparsentan is momenteel nog niet geregistreerd voor gebruik in Europa.
Commentaar
Op basis van de gegevens over SGLT2-remmers bij chronische nierschade in het algemeen en nieuwe gegevens over SLGT2-remmers bij IgAN, die nog niet in de KDIGO richtlijn glomerulaire nierziekten zijn verwerkt, heeft de richtlijn commissie gekozen om SGLT2-remmers al wel een specifieke plaatst te geven voor de conservatieve behandeling van IgAN. Daarnaast adviseert de commissie te streven naar <0.3 g proteïnurie per dag voor de best haalbare renale prognose.
Aanvullende NFN aanbeveling
In geval van persisterende proteïnurie >0.3 g/d met maximale dosis ACEi of ARB en optimalisatie van conservatieve maatregelen en bloeddrukregulatie acht de NFN het zinvol om een SGLT2-remmer toe te voegen aan de behandeling (1B).
2.3.1 Patients with IgAN who are at high risk of progressive CKD despite maximal supportive care.
Practice Point 2.3.1.1: Considerations for treatment of patients with IgAN who are at high risk of progressive CKD despite maximal supportive care.
Commentaar
De NFN acht het zinvol om bij patiënten met een hoog risico op progressie van CNS, samen af te wegen met de patiënt af te wegen of de patiënt eerst in aanmerking komt voor behandeling met prednison in plaats van deelname aan een klinische trial (zie ook 2.3.1.3).
Practice Point 2.3.1.2: Proteinuria reduction to under 1 g/d is a surrogate marker of improved kidney outcome in IgAN, and reduction to under 1 g/d is a reasonable treatment target.
Commentaar
Geen aanvullend commentaar.
|
Recommendation 2.3.1.1: We suggest that patients who remain at high risk of progressive CKD despite maximal supportive care be considered for a 6-month course of glucocorticoid therapy. The important risk of treatment-emergent toxicity must be discussed with patients, particularly those who have an eGFR <50 ml/min/1.73m2 (2B). |
Practice Point 2.3.1.3: Use of glucocorticoids in IgAN:
|
Figure 23 | Situations when glucocorticoids should be avoided, or administered with great caution.
*The Therapeutic Evaluation of Steroids in IgA Nephropathy Global (TESTING)109 study included patients with eGFR 20–30 ml/min per 1.73 m2, but only 26 patients in total had this range of kidney function. Prespecified subgroup analyses for signals of efficacy and toxicity were underpowered and did not distinguish patients with eGFR < 30 ml/min per 1.73 m2.† High BMI in the TESTING study was not specifically considered an exclusion, but the mean BMI was <24 kg/m2. BMI, body mass index; eGFR, estimated glomerular filtration rate; TB, tuberculosis. |
Onderbouwing
De NFN volgt de behandelschema’s uit de KDIGO richtlijn voor de behandeling met steroïden. De KDIGO richtlijn spreekt geen specifieke voorkeur uit voor de exacte dosis en het afbouwschema voor behandeling met steroïden. Nieuwe informatie komt van een recente gerandomiseerde gecontroleerde studie, de TESTING trial, uitgevoerd in Australie, Canada, China, India en Maleisie onder 503 deelnemers van gemiddeld 38 jaar, eGFR 61.5 ml/min, systole 124.5 mmHg en proteïnurie 2.46 g/d.(12) Deze studie toonde een significant voordeel voor de met steroïden behandelde groep (HR 0.52; 95%CI 0.39-0.72) (uitkomstmaat 40% daling in eGFR, eindstadium nierfalen of overlijden door nierziekte). In deze studie werden patiënten behandeld met oraal methylprednisolon; aanvankelijk in een dosis van 0.6-0.8 mg/kg/d (equivalent aan prednisolon 1 mg/kg/d), hetgeen na 2 maanden werd afgebouwd met 8 mg/mnd (equivalent prednisolon 10 mg/mnd). Vanwege een toename aan SAE door infectie in de groep met steroïden, waarvan 4 door PCP, werd halverwege de studie het protocol gewijzigd. PCP profylaxe werd toegevoegd en de startdosis werd verlaagd naar 0.4 mg/kg/d (equivalent aan prednisolon 0.5 mg/kg/d), hetgeen na 2 maanden werd afgebouwd met 4 mg/mnd (equivalent prednisolon 5 mg/mnd). Ook bij deze lagere dosis werd een significant voordeel gezien voor behandeling met steroïden. De hogere dosis leidde tot een number needed to treat (NNT) benefit van 8.5 versus harm 8.1. Voor het schema met de lagere dosis was de NNT benefit 6 versus harm 41. Kanttekening is dat de TESTING populatie voor 95% Zuid-Oost Aziatische patiënten betreft en dat de populatie een relatief snelle achteruitgang van eGFR per jaar had (-5ml/min/j).(13)
Commentaar
Vanwege de beschikbaarheid adviseert de NFN gebruik van prednisolon in plaats van methylprednisolon per os. Op basis van de TESTING studie lijkt een schema met lagere dosis de voorkeur te verdienen met een startdosis van 0.5 mg/kg/d (maximaal 40 mg) gedurende 2 maanden, gevolgd door een afbouwschema met reductie van de dosis met 5 tot 10 mg per maand. De behandelduur is 6 maanden. Bij snel progressief nierfunctieverlies kan een hogere dosis van 1mg/kg/d (maximaal 60 mg) aangewezen zijn.
Commentaar
Voor profylaxe adviezen voor patiënten met glomerulonefritis die immunosuppresiva gebruiken wordt verwezen we naar de NFN richtlijn ‘Glomerulonefritis hoofdstuk 1 algemene principes en behandeling’.
Practice Point 2.3.1.4: Management of patients with IgAN who remain at high risk for progression after maximal supportive care
 Figuur: behandeling IgA nefropathie. Deze figuur betreft het NFN advies op basis van de huidige kennis van zaken. Vervangt practice point 2.3.1.4 en figuur 24 uit KDIGO richtlijn
Figuur: behandeling IgA nefropathie. Deze figuur betreft het NFN advies op basis van de huidige kennis van zaken. Vervangt practice point 2.3.1.4 en figuur 24 uit KDIGO richtlijn
Practice Point 2.3.1.5: Other pharmacologic therapies evaluated in IgAN (Figure 25)
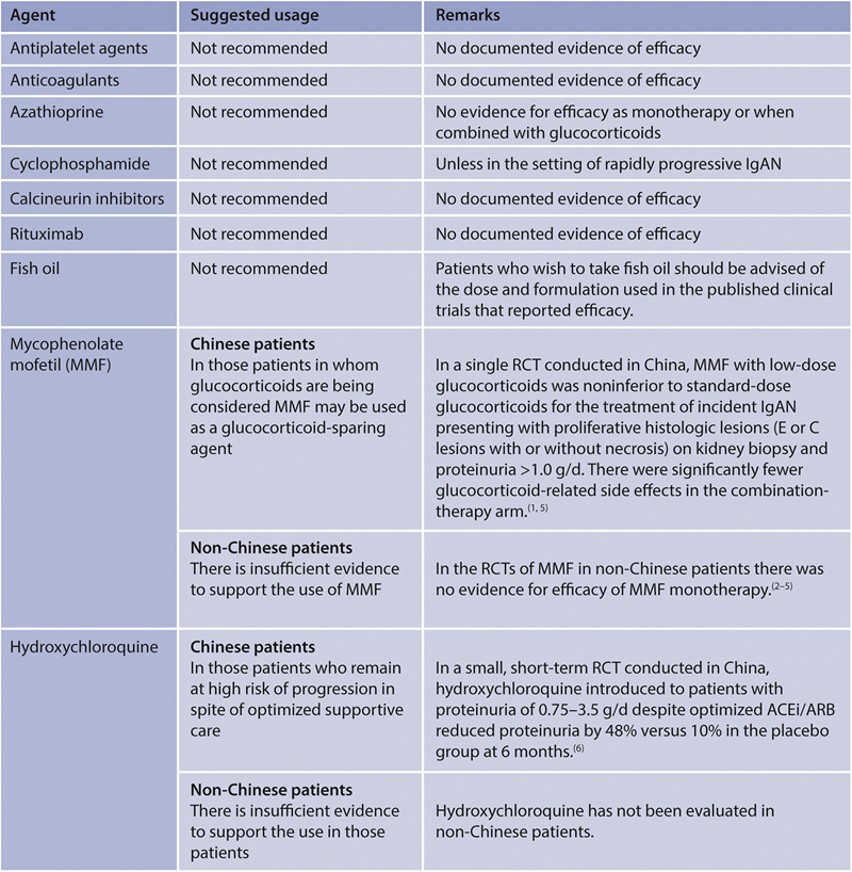
Onderbouwing
Mycophenolate mofetil (MMF)
Sinds het verschijnen van de KDIGO richtlijn in 2021 is een gerandomiseerde gecontroleerde studie verricht naar het effect van MMF bij Chinese patiënten met IgAN (MAIN trial).(14) Na een ‘run-in’ fase van 3 maanden waarin ‘supportive care’ werd geoptimaliseerd werden 170 patiënten gerandomiseerd naar MMF en conservatieve behandeling of alleen conservatieve behandeling. De gemiddelde leeftijd was 37 jaar, eGFR 50 ml/min/1.73m2 (SD 18), bloeddruk 126/82 mmHg en proteïnurie 1.9 g/d. De dosis MMF was 1.5 g/d gedurende 12 maanden, gevolgd door 0.75-1.0 g/d gedurende minimaal 6 maanden. De primaire uitkomstmaat was een gecombineerd eindpunt bestaande uit verdubbeling serum kreatinine, eindstadium nierfalen of overlijden door nierfalen. Dit trad op bij 7% in de MMF groep en 21% in de controle groep (HR 0.23, 95% CI 0.09-0.63). De proteïnurie nam in de MMF groep af met 57% versus 28% in de controle groep. De gemiddelde jaarlijkse daling in eGFR was 1.2 ml/min/jr in de MMF groep en 3.8 ml/min/jr in de controle groep. Het aantal adverse events en serious adverse events was gelijk. In de post-trial fase nam, na het stoppen van MMF, de jaarlijkse daling in eGFR toe, maar bleef iets kleiner in de groep die MMF had gehad dan de controle groep. Kanttekening: De studie is uitgevoerd onder Chinese patiënten. Dat generaliseerbaarheid naar de Nederlandse situatie is onbekend. Andere gecontroleerde studies met MMF met kleinere aantallen deelnemers, waaronder kaukasische patiënten (n=52, n=32, n=34) toonden geen significant effect.(15–17)
Targeted-release formulation (TRF) van budesonide (Nefecon, Kenpeygo).
Sinds het verschijnen van de KDIGO richtlijn in 2021 is naast een eerdere fase 2b studie een fase 3 gerandomiseerde placebo gecontroleerde studie verricht naar het effect van Nefecon 16 mg bij patiënten met persisterende proteïnurie (> 1 gram/ 24h of eiwit/kreatinine ratio > 90 mg/mmol) ondanks optimale conservatieve therapie gedurende minimaal 3 maanden vooraf aan inclusie.(18–20). De 364 deelnemers, voornamelijk afkomstig uit Europa en de Verenigde Staten, hadden een mediane leeftijd van 44 jaar, bloeddruk 125/79 mmHg, eGFR 56 ml/min/1.73m2 en niet lager dan 35 ml/min/1.73m2, gemiddelde proteïnurie 2.7 g/24h, waarvan iets meer dan de helft meer dan 2 g/24h, gemiddelde eiwit/kreatinine ratio (EKR) 131 mg/mmol en albumine/kreatinine ratio van 103 mg/mmol. Minder dan 10% had voorheen immuunmodulerende behandeling gehad. Er was een significante afname in proteïnurie. Het maximale verschil werd bereikt na 12 maanden, dat is 3 maanden na het stoppen van de budesonide (afname van 51% t.o.v. de uitgangswaarde bij gebruik van Nefecon en afname van 3% bij gebruik van placebo). Na 24 maanden was het verschil kleiner geworden (-31% vergeleken met -1%), hetgeen laat zien dat het effect niet bestendig is na het stoppen van de medicatie. De optimale therapieduur of interval waarmee de behandeling kan of dient te worden gegeven is onbekend. Het primaire eindpunt was significant. De tijd-gewogen gemiddelde eGFR over het beloop van 2 jaar daalde met 2.47 mL/min/1.73m2in de Nefecon groep en met 7·52 mL/min/1·73 m2 in de placebo groep, een verschil van 5·05 mL/min/1.73m2. Het absolute verschil na twee jaar was – 6.11 versus -12 mL/min/1.73m2 en de ‘slope’ verschilde 2.95 mL/min/1.73m2/jr. Het gunstige effect was significant bij zowel de subgroep met een EKR >133 mg/mmol) als bij de groep met een EKR <133mg/mmol. Dit alles vertaalde zich in een Hazard ratio van 0.45 (95% CI 0.26-0.75) op een daling in eGFR van meer dan 30% of nierfalen, ten gunste van het gebruik van Nefecon. Kanttekening is dat er na aanvang van Nefecon in de subgroep met EKR <133 mg/mmol een stijging in de eGFR optrad en dat daarna de ‘slope’ gelijk leek te zijn in beide groepen. In de groep die Nefecon kreeg werd vaker een stijging in bloeddruk (12% versus 3%, perifeer oedeem (17% versus 4%, spierkramp (12% versus 4%) en acne gerapporteerd (11% versus 1%).[3]
[3] Budesonide-TRF is door EMEA geregistreerd onder de naam Kenpeygo (https://www.ema.europa.eu/en/documents/product-information/kinpeygo-epar-product-information_en.pdf). Het is ontwikkeld om te zorgen voor lokale afgifte in het terminale ileum en colon. Van het middel wordt 23% afgeleverd in het terminale ileum en ileo-coecaal en 52% in het colon ascendens.(27) Het is in Nederland nog niet verkrijgbaar. Voor de behandeling van inflammatoire darmziekten is wel een maagsapresistente capsule met gereguleerde afgifte van budesonide beschikbaar, Entocort 9 mg. Het wordt voor circa 35% afgeleverd in het ileum en 35% in het colon ascendens.(28) Het preparaat Entocort is niet onderzocht bij patienten met IgAN.
Commentaar
Het effect van MMF in de MAIN trial pleit voor het gebruik van dit middel. Belangrijkste kanttekening is dat het gunstige effect niet consistent is over de verschillende gerandomiseerde studies en dat het een andere etnische populatie (Oost-Aziatisch) betreft. Voor budesonide targeted release zijn de resultaten veelbelovend. Het heeft een relatief gunstig bijwerkingen profiel ten opzichte van orale steroïden en het effect op de nierfunctie lijkt vergelijkbaar te zijn. De optimale plaatsbepaling en de optimale duur van de behandeling is onbekend. Ook is onbekend wat het effect zal zijn van een herhaalde behandeling als proteïnurie toeneemt.
Aanvullend NFN practice point
De NFN acht het zinvol om MMF of budesonide targeted-release toe te voegen, indien deelname aan een studie niet mogelijk is en er contra-indicaties zijn voor het gebruik van prednisolon. Gelet op de extrapoleerbaarheid van de data naar de Nederlandse situatie, lijkt er volgens de NFN een voorkeur te zijn voor budesonide targeted release boven MMF.
Practice Point 2.3.1.6: Tonsillectomy in IgAN:
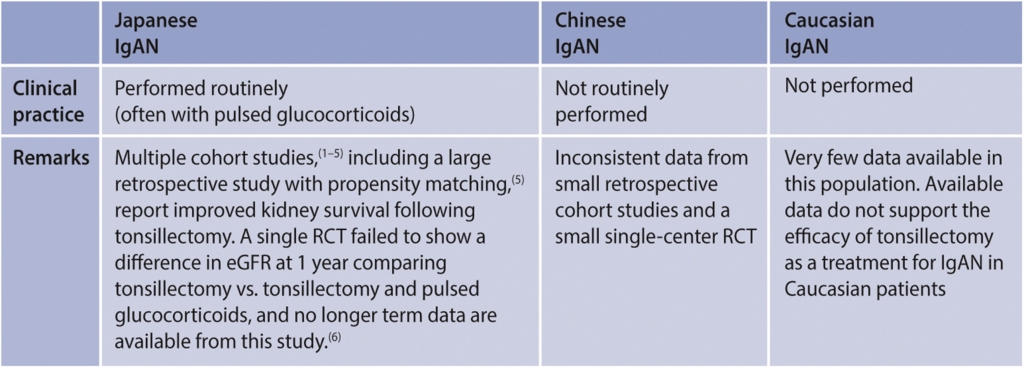
Commentaar
Geen aanvullend commentaar.
Practice Point 2.4.1: IgAN with nephrotic syndrome:
Commentaar
Voor goede beoordeling van het nierbiopt dient de patholoog hier voldoende ervaring mee te hebben en dient er EM beschikbaar te zijn (zie ook practice point 1.1.2 en bijbehorend NFN practice point in Nederlandse adaptatie van hoofdstuk 1 van KDIGO glomerulaire ziekten.
Practice Point 2.4.2: IgAN with AKI:
Commentaar
Geen aanvullend commentaar.
Practice Point 2.4.3: IgAN with RPGN:
Commentaar
Voor profylaxe adviezen voor patiënten met glomerulonefritis die immunosuppresiva gebruiken wordt verwezen we naar de NFN richtlijn ‘Glomerulonefritis hoofdstuk 1 algemene principes en behandeling’.
Practice Point 2.4.4: IgAN and pregnancy planning:
Commentaar
De commissie verwijst naar de FMS multidisciplinaire richtlijn Kinderwens en Zwangerschap bij Chronische Nierschade.
General considerations
Kidney biopsy in children
Treatment
Commentaar
De huidige richtlijn is gebaseerd op dezelfde literatuur als de editie uit 2012. Volgens de auteurs zijn er in de tussentijd geen studies of publicaties over de behandeling van IgAN bij kinderen verschenen die van voldoende kwaliteit waren om een behandeladvies op te baseren. In een artikel n.a.v. de publicatie van de nieuwe KDIGO-richtlijn, bediscussieert R. Coppo de verschillen in beloop en prognostische factoren tussen kinderen en volwassenen met IgA-nefropathie.(21)
Follow-up
Commentaar
De ESCAPE-trial (ESCAPE Trial Group), een gerandomiseerde studie bij kinderen (leeftijd 3 t/m 18 jaar) met CNS (geschatte nierfunctie (eGFR) van 15-80 ml/min/1.73m2) heeft aangetoond dat strikte bloeddrukverlaging ook bij kinderen de nierfunctie spaart.(22) Patiënten werden behandeld met een ACE-remmer (ramipril in vastgestelde dosis) plus andere antihypertensieve middelen met als streven de 24-uursbloeddruk te verlagen tot <50e percentiel danwel tot tussen de 50e en 95e percentiel. Intensieve antihypertensieve therapie (streefwaarde <50e percentiel) leidde er toe dat de achteruitgang van de nierfunctie significant minder was dan bij controle-patiënten (streefwaarde tussen de 50e en 95e percentiel). Het gunstige effect van bloeddrukverlaging was meer uitgesproken bij patiënten met glomerulopathie dan bij patiënten met CNS t.g.v. hypo- / dysplasie van de nieren. Nadere analyse van de data van de ESCAPE-studie liet zien dat de achteruitgang van de nierfunctie minder was naarmate de proteïnurie meer werd beperkt.(23) Dit effect was onafhankelijk van leeftijd, geslacht, oorzaak van de CNS, uitgangswaarden van eGFR en proteïnurie, bloeddruk bij aanvang en bereikte bloeddrukdaling. Deze data zijn niet specifiek voor patienten met IgAN. Gelet op de overeenkomsten met de bevindingen bij de volwassen populatie is de commissie van mening dat deze data wel kan worden ge-extrapoleerd naar de populatie met IgAN.
Practice Point 2.5.1: Considerations for the diagnosis of immunoglobulin A vasculitis (IgAV):
Commentaar
Immunoglobulin A (IgA) vasculitis, ook wel Henoch-Schönlein purpura (HSP) genaamd, is een kleine vaten vasculitis met depositie van immuun complexen, waarin IgA antilichamen. Vooral huid, darmen, gewrichten en nieren zijn betrokken. Er is een nieuwere referentie voor de classificatie criteria.(24) Hieronder de classificatie criteria uit dat artikel.

EULAR/PRINTO/Paediatric Rheumatology European Society-endorsed Ankara 2008 criteria should be used to classify IgAV. This was because they were developed based on a large international registry of patients and were validated specifically for childhood-onset disease. Classification criteria, however, should not be used as diagnostic criteria.
Practice Point 2.6.1: Considerations for the prognostication of IgAV:
Commentaar
Geen aanvullend commentaar.
2.7.1 Prevention of nephritis in IgAV
|
Recommendation 2.7.1.1: We recommend not using glucocorticoids to prevent nephritis in patients with isolated extrarenal IgAV (1B). |
Practice Point 2.7.1.1: Considerations for the treatment of all patients with IgAV-associated nephritis (IgAVN) who do not have an RPGN:
2.7.2 Patients with IgAVN who are at high risk of progressive CKD despite maximal supportive care.
Practice Point 2.7.2.1: Considerations for the treatment of patients with IgAVN who are at high risk of progressive CKD despite maximal supportive care:
Commentaar
de NFN is van mening dat de behandeling van IgAV qua immuunsuppressie afhankelijk is van de presentatie en dat de duur van de behandeling afhankelijk is van de kliniek. Het behandelschema zoals voor IgAN is hierin niet strikt leidend.
Practice Point 2.8.1: IgAV with RPGN:
Commentaar
Er is een nieuwere versie van de richtlijn van de American Society for Apheresis.(25)
2.8.1 IgAV-associated nephritis in children
Practice Point 2.8.1.1: For the purposes of this practice point, children are defined as those aged <18 years. It is acknowledged that post-pubertal children in some respects may have a similar course and response to treatment as adults with IgAN, but there are insufficient data currently to recommend that they be managed as adults with IgAN. Indications for management of IgAVN in children have recently been published as the result of a European consortium initiative.140 Briefly:
Commentaar
In 2019 verscheen een Europese richtlijn IgA-vasculitis (IgAV, voorheen: Henoch Schönlein purpura). Deze richtlijn bevat 26 adviezen voor diagnostiek en behandeling van IgAV, waarvan 21 door de auteurs zelf werden aangemerkt als “expert opinion” waaronder alle adviezen m.b.t. de behandeling van IgAV-nefritis. De richtlijn geeft een indeling naar ernst van IgAV-nefritis (mild – moderate – severe- persistent proteinuria) en behandeladviezen aan de hand hiervan.(26)
© 2022. Alle rechten voorbehouden
Een levende richtlijn is een richtlijn waarvan het onderhoud op continue basis plaatsvindt, op grond van systematische monitoring van zowel de medisch wetenschappelijke literatuur als praktijkgegevens en door gebruikers van de richtlijn aangeleverde commentaren. Voor deze richtlijn is de volgende procedure voor het actueel houden opgesteld. De richtlijn vasculitis zal driejaarlijks worden getoetst aan de wetenschappelijke ontwikkelingen door de IgAN werkgroep die in zijn huidige samenstelling zal doorgaan. De werkgroep draagt de verantwoordelijkheid om tussentijdse peilingen bij de beroepsgroep te verrichten naar behoefte voor herziening(en) van de huidige richtlijn.