Screening op intracraniële aneurysma bij patiënten met Autosomaal Dominante Polycysteuze Nierziekte (ADPKD)
Autorisatiedatum: 01-06-2022
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
Patiënten met autosomaal dominante polycysteuze nierziekte, afgekort ADPKD (van het Engelse Autosomal Dominant Polycystic Kidney Disease) hebben een verhoogd risico op het krijgen van een intracranieel aneurysma. Rond hun 50ste levensjaar heeft ongeveer 10% van de patiënten met ADPKD een intracranieel aneurysma, in vergelijking met 3% van de algemene populatie.1-3 Bij ADPKD patiënten die familieleden hebben met een intracranieel aneurysma of een intracraniële bloeding, loopt de kans op het vinden van een intracranieel aneurysma op tot boven de 20%.4 Dit verhoogde risico op aneurysmata wordt toegeschreven aan de verandering van polycystine-1 en polycystine-2 eiwitten in de vaatwand, dit zijn de eiwitten die in ADPKD zijn aangedaan. Waarom deze verandering in de eiwitten leidt tot een verminderde stevigheid van de vaatwand, is tot op heden onbekend.5
Als een aneurysma knapt, ontstaat een subarachnoïdale bloeding (SAB). Dit is een ernstige aandoening, waarbij één op de drie patiënten overlijdt en in één op de drie ernstig neurologische schade ondervindt. Om dit te voorkomen, kun je patiënten screenen op de aanwezigheid van aneurysmata. Indien die er zijn, kunnen deze vroegtijdig behandeld worden middels coiling of clippen van het aangedane bloedvat. Over de vraag wie gescreend moet worden, zijn de meningen verdeeld.
De huidige internationale consensus adviseert om ADPKD patiënten met een familiair risico voor intracraniële aneurysmata te screenen op de aanwezigheid van een intracranieel aneurysma6. Men is van oudsher terughoudend geweest ten aanzien van het invoeren van routinematige screening voor alle ADPKD patiënten in verband met de vaak kleine aneurysmata met lage kans op bloeding, risico van preventieve interventies, kosten die hiermee gepaard gaan, alsmede ook de veronderstelde psychologische belasting van dit traject.
Er gaan stemmen op om over te gaan op screening van alle ADPKD patiënten, naar aanleiding van twee recente onafhankelijk uitgevoerde kosten-effectiviteitsstudies7,8, die lieten zien dat screening van alle ADPKD patiënten (inclusief patiënten zonder positieve familieanamnese voor een aneurysma of SAB) kosteneffectief is met winst in zogenaamde quality-adjusted life-years (QALYs). Dit advies is overgenomen in de Nederlandse richtlijn ‘ongeruptureerd intracranieel aneurysma’ geschreven door de Nederlandse verenigingen van neurochirurgie, neurologie en radiologie (https://richtlijnendatabase.nl/richtlijn/ongeruptureerd_intracranieel_aneurysma/startpagina_-_ongeruptureerd_intracranieel_aneurysma.html).9
Het doel van deze huidige richtlijn is een standpunt formuleren vanuit de NFN ten aanzien van het screenen op intracraniële aneurysmata bij ADPKD patiënten, naar aanleiding van de bovengenoemde ontwikkelingen. In deze richtlijn wordt de recente literatuur ten aanzien van intracraniële aneurysmata bij ADPKD patiënten kort besproken. Er wordt een aanbeveling gedaan wanneer wel en niet te screenen waarbij ook de verschillende taken en verantwoordelijkheden in het screeningsproces worden belicht. Ten slotte worden er suggesties gedaan hoe de taken tussen de betrokken disciplines verdeeld en hoe de logistieke procedures ingericht zouden kunnen worden.
INITIATIEF: Soonawala, M. Vervloet en E. Meijer, internist-nefrologen
Deze tekst is opgesteld door drs J.E. Heida (promovendus UMCG), dr Y.M.Ruigrok (vasculair neuroloog UMCU) en dr E. Meijer (internist-nefroloog UMCG) en aangepast en van commentaar voorzien door internist-nefrologen met expertise op gebied van ADPKD: dr D. Soonawala (internist-nefroloog Haga ziekenhuis en LUMC), prof. dr. M.G. Vervloet, Amsterdam UMC, prof. dr. R. Zietse, Erasmus MC, dr. M. Salih, Erasmus MC, prof. dr. R.T. Gansevoort, UMCG en prof. dr. T. Nijenhuis, Radboudumc en vasculair neurologen met expertise op gebied van aneurysmata: dr M. Uyttenboogaart, UMCG en Prof. dr. M.J.H. Wermer, LUMC.
Tekst is ter ondersteuning voorgelegd aan de NvN (nierpatiëntenvereniging Nederland), diagnosegroep cystenieren en is aan de Nederlandse Vereniging voor Neurochirurgie en Neurologie voorgelegd
Aanbevelingen
De associatie tussen ADPKD en intracraniële aneurysmata en mogelijkheid tot screening moet met ADPKD patiënten besproken worden.
Wij adviseren te screenen op intracraniële aneurysmata bij volwassen ADPKD patiënten vanaf het stellen van de diagnose en pas vanaf de leeftijd van 20 jaar als de diagnose ADPKD al jonger gesteld is, als:
Screening kan worden overwogen bij patiënten zonder positieve familie anamnese of zonder voorgeschiedenis van intracraniële aneurysmata, bijvoorbeeld op expliciet verzoek van de patiënt.
Follow-up screening dient bij voorkeur elke 5 jaar te worden aangeboden bij personen tot 75 jaar, ook na start dialyse of niertransplantatie, zolang patiënt in klinisch goede conditie is en geen beperkte levensverwachting heeft.
Het is belangrijk de voor- en nadelen van screening op intracraniële aneurysmata te bespreken alvorens voor het eerst een keuze tot wel of niet screenen gemaakt wordt door de patiënt. Het verdient de voorkeur dat een specialist met ervaring en kennis dit counselingsgesprek voert, bijvoorbeeld een (vasculair) neuroloog.
Modaliteit van voorkeur van screening is een 3D time of flight MR angiogram van het hoofd, omdat hierbij geen contrastvloeistof hoeft te worden gegeven.
Het wordt aangeraden afspraken te maken over de verdeling van taken met betrekking tot screening op intracraniële aneurysmata binnen het ziekenhuis.
Het doel van screening op intracraniële aneurysmata is het voorkómen van een subarachnoïdale bloeding (SAB) door knappen van een aneurysma. Dit is een ernstige aandoening. Na een SAB overlijdt ongeveer één derde van de patiënten10,11 en een derde van de patiënten raakt ernstig gehandicapt door de SAB. Indien een intracranieel aneurysma tijdig wordt opgespoord, kan deze preventief worden behandeld middels een neurochirurgische of een endovasculaire ingreep (respectievelijk aangeduid als clippen of coilen), om daarmee een bloeding uit het aneurysma in de toekomst te voorkomen.
Aangezien patiënten met ADPKD een verhoogd risico hebben op het krijgen van een intracranieel aneurysma en een SAB uit zo’n aneurysma, kan het implementeren van een screeningsbeleid in deze patiëntenpopulatie zinvol zijn om SABs te voorkomen. Op dit moment verschilt het screeningsbeleid per behandelend specialist. Sommige specialisten zullen voornamelijk ADPKD patiënten met een positieve familieanamnese screenen, terwijl andere specialisten ook ADPKD patiënten zonder positieve familie anamnese screenen.12 Daarnaast wordt onder een positieve familieanamnese niet altijd hetzelfde verstaan: dit kan alleen een aangetoond aneurysma of bewezen aneurysma ruptuur zijn, maar ook een hersenbloeding of beroerte van onbekende origine.
Om uniformiteit te creëren, is deze richtlijn opgesteld. Deze richtlijn spreekt zich uit voor een zogenaamd restrictief screeningsbeleid, dat wil zeggen dat wordt aangeraden alleen patiënten met een hoog risico te screenen op intracraniële aneurysmata. Dit is conform de huidige internationale consensus. Hierin wordt aangeraden ADPKD patiënten met een familiair risico te screenen op de aanwezigheid van een intracranieel aneurysma.6 Een familiair risico wordt dan gedefinieerd als het voorkomen van een bekend intracranieel aneurysma, een aneurysma ruptuur of een SAB dan wel vermoeden op een SAB (plotse dood, intracraniële bloeding van onbekende origine) bij een 1e– of 2e-graads familielid.
Het alternatief is alle ADPKD patiënten screening aan te bieden, zogenaamde systematische screening. Belangrijkste argument hiervoor is dat de prevalentie van intracraniële aneurysmata hoog is in de gehele ADPKD populatie, niet alleen onder de patiënten met aangedane familieleden. Tot 80% van de SABs vindt namelijk plaats bij ADPKD patiënten zonder positieve familie anamnese.13-15 Aanvullende karakteristieken om ADPKD patiënten met een verhoogd risico op SAB te kunnen identificeren zijn tot nu toe nog niet met zekerheid vastgesteld. Een recente studie signaleert dat mogelijk er een verhoogd risico is voor patiënten met een PKD1 mutatie, al wordt dit door data van andere populaties tegengesproken.16,17
De beste methode om de effectiviteit van screening te onderzoeken zou een gerandomiseerde klinische trial zijn waarbij de strategie van screening en preventieve behandeling vergeleken wordt met niets doen. Beide cohorten zouden gedurende een zeer lange tijd vervolgd moeten worden en dat maakt de uitvoering van zo’n trial vrijwel onmogelijk. In dergelijke omstandigheden waarbij een trial praktisch niet uitvoerbaar blijkt, zijn modelmatige simulatie studies een geschikt alternatief.18 In dit geval wordt het betoog voor systematische screening ondersteund door de uitkomsten van twee van deze modelmatige simulatiestudies, uitgevoerd in Frankrijk en de VS.7,8 Hierbij wordt de schade die veroorzaakt wordt door een SAB, afgewogen tegen het complicatierisico van de preventieve ingreep. Het is belangrijk zich te realiseren dat in de meeste gevallen, een intracranieel aneurysma niet tot een SAB leidt, terwijl de preventieve behandeling niet zonder risico’s is. De geschatte morbiditeit van ingrijpen ter preventie van een SAB is 4-8% en de mortaliteit 0.1-0.3% in de algemene populatie.19 Al deze overwegingen meenemend, wordt er berekend dat systematische screening een winst van 1.3 quality adjusted life year (QALY) oplevert versus niet screenen en 0.7 QALY vergeleken met gerichte screening. Bij 90% van de simulaties is systematische screening kosteneffectief bij een bereidheid €50.000 per QALY te betalen.7 In Nederland is de grens van het te besteden bedrag per QALY gesteld op €80.000 voor ernstige aandoeningen.20 Meest kosteneffectief is om screening elke 5 jaar te herhalen.8
Men kan zich afvragen of de vertaalslag naar de Nederlandse praktijk zomaar gemaakt kan worden. Nederlandse data over aneurysmata bij ADPKD patiënten ontbreken. Een arts-onderzoeker van het Universitair Medisch Centrum Groningen heeft daarom in de ADPKD populatie van het UMCG retrospectief gegevens over het voorkomen van intracraniële aneurysmata en het optreden van SABs verzameld, in de periode van 2002 tot 2020. In deze studie, met een relatief kleine sample size, werd een prevalentie van aneurysmata in de gescreende groep van 8% gevonden (in 6 van de 76 patiënten) en werd een ruptuur risico van 1.1 per 1000 patiëntjaren gevonden (in 5 patiënten uit de totale populatie van 257 patiënten) (ongepubliceerde data). Deze getallen liggen redelijk in dezelfde range als de aannames die in de kosten-baten analyses werd gedaan. Hiermee lijken die studies de Nederlandse situatie in redelijke mate te weerspiegelen.
Er blijven echter onzekerheden over na deze studies. Bij het uitvoeren van deze berekeningen worden verschillende aannames gedaan, want niet alle benodigde informatie is beschikbaar. Ten eerste is er nooit een studie gedaan naar het natuurlijk beloop van de groei van intracraniële aneurysmata en het risico op SAB uit zo’n groeiend aneurysma. Het is aannemelijk dat als er wordt ingeschat dat de kans op een SAB hoog is, een aneurysma preventief behandeld wordt. Hierdoor zal er naar alle waarschijnlijkheid sprake zijn van een onderschatting van het werkelijke risico op een SAB in een populatie.
Ten tweede is een deel van de gegevens, die gebruikt zijn voor deze simulatiestudies, afkomstig van cohortstudies van mensen uit de algemene populatie met een familiair risico voor intracraniële aneurysmata of SAB (waarvan in sommige studies een klein gedeelte ADPKD heeft). Deze gegevens zijn specifiek voor de ADPKD populatie (nog) niet verzameld. Of het natuurlijk beloop van aneurysmata bij ADPKD anders is, is niet met zekerheid te zeggen. Er zijn studies die suggereren dat een SAB op lagere leeftijd (41 versus 51 jaar) en bij kleinere aneurysmata optreedt dan in de algehele bevolking.15,21 Wat dat betreft lijkt het ruptuurrisico van een aneurysma bij ADPKD patiënten dus hoger dan bij patiënten met een aneurysma zonder ADPKD uit de algemene populatie. Ook kan uit deze data worden opgemaakt dat aneurysmata bij ADPKD patiënten mogelijk bij een kleinere diameter en op jongere leeftijd knappen, waardoor je in deze patiëntenpopulatie wellicht eerder preventieve behandeling moet overwegen dan in de populatie van patiënten met een aneurysmata zonder ADPKD. Aan de andere kant is het risico op complicaties van de interventie in de ADPKD populatie mogelijk groter dan in de algemene populatie22, wat maakt dat de winst van QALY kleiner wordt.
Ten slotte moet worden opgemerkt dat in deze studies kwaliteit van leven wordt uitgedrukt op basis van de neurologische uitkomst. De psychologische effecten van screening worden daarmee onderbelicht. Aan de ene kant kan screening een positief effect hebben op de gemoedstoestand. ADPKD patiënten zijn zich soms bewust van het risico op een SAB, en de mogelijkheid van screening kan daarom geruststelling brengen. Aan de andere kant kan screening een klein aneurysma aan het licht brengen, dat nog geen behandeling behoeft. Ook kan er een moeilijk behandelbaar of zelfs niet-behandelbaar aneurysma of intracraniële toevalsbevindingen gevonden worden.23-25Een Nederlandse studie die deze psychologische effecten van screening op aneurysmata heeft onderzocht in de algemene populatie, heeft laten zien dat kennis van het hebben van een intracranieel aneurysma de kwaliteit van leven vermindert. Hiermee wordt het belang van goede counseling vooraf onderstreept, maar ook kan dit worden gezien als een mogelijk hiaat in de bovengenoemde simulatiestudies.23
Gezien de onzekerheden ten aanzien van de beschikbare data, de vaak kleine aneurysmata met lage kans op bloeding, de complicaties die kunnen ontstaan bij een preventieve electieve ingreep en de financiële kosten en belasting van het zorgsysteem van screenen, alsmede ook de veronderstelde psychologische belasting van dit traject, wordt in deze richtlijn vooralsnog vastgehouden aan een restrictief screeningsbeleid.
Wat zijn de risico’s van een preventieve interventie?
Preventieve interventie is niet zonder risico. Preventieve behandeling van een aneurysma kan bijvoorbeeld een herseninfarct veroorzaken, door afsluiting of vaatspasme van een arterie tijdens de procedure, of, zij het zeldzaam, een bloeding vanuit het aneurysma. Deze complicaties komen zowel bij endovasculair coilen als bij neurochirurgisch clippen voor, al geldt voor de laatste dat hierbij het risico hoger is. In een recent systematisch review, waarin 114 studies werden geïncludeerd (met hierin 106 433 patiënten met 108 263 aneurysmatas) was het risico op bloedingscomplicaties 0.9% voor endovasculaire behandeling versus 1.23% voor neurochirurgische behandeling. Het procedurele risico op optreden van een klinische complicatie (geduid als (tijdelijke) achteruitgang van patiënt gedurende 30 dagen na de ingreep) was 4.96% voor endovasculaire behandeling en 8.34% voor neurochirurgische behandeling. Bij interpretatie van deze getallen moet worden meegenomen dat in deze studie geen onderscheid werd gemaakt tussen tijdelijke en blijvende neurologische schade. Ten slotte werd er een mortaliteit gezien tijdens de procedure of gedurende de eerste 30 dagen nadien van 0.30% voor de endovasculaire behandeling en 0.10% voor neurochirurgische behandeling.19 Deze studie betrof met name data van personen uit de algemene populatie en deze hieruit te trekken conclusies zijn dus niet ADPKD-specifiek. Dit is relevant, omdat in literatuur wordt gesuggereerd dat het risico op complicaties van behandeling groter is bij ADPKD patiënten dan in de algemene populatie, al is het aantal geïncludeerde patiënten in deze studie te klein om betrouwbare conclusies te trekken.22,26 Aan de andere kant wordt er ook gesuggereerd dat aneurysmata bij ADPKD patiënten op een jongere leeftijd en bij een kleinere diameter knappen dan in de algemene populatie, waardoor de noodzaak tot ingrijpen groter wordt.15,21 De beslissing wel of niet voor behandeling van een aneurysma te kiezen wordt gemaakt in een gespecialiseerd MDO en valt buiten bestek van deze richtlijn (zie richtlijn ongeruptureerd aneurysma).9
Vanaf welke leeftijd moet worden gestart met screening?
In deze richtlijn stellen we voor om volwassen ADPKD patiënten met een positieve familieanamnese screening op de aanwezigheid van een intracranieel aneurysma aan te bieden. Dit screeningstraject kan worden opgestart nadat de diagnose ADPKD gesteld is en pas vanaf de leeftijd van 20 jaar als de diagnose ADPKD jonger gesteld is. Twintig jaar is de leeftijdsgrens die is vastgesteld in de nationale richtlijn ‘ongeruptureerd intracranieel aneurysma’ voor patiënten met een positieve familiegeschiedenis voor SAB.9 Van deze leeftijd wordt uitgegaan vanwege de uitkomsten van de kosten-effectiviteitsstudies hebben, die aantoonden dat elke 5 jaar screenen gedurende het hele leven met start vanaf 20 jaar de meest optimale strategie is.8 Het is niet exact bekend op welke leeftijd intracraniële aneurysmata ontstaan bij ADPKD patiënten, aangezien er over het natuurlijk beloop van aneurysmata weinig bekend is. ADPKD patiënten die een SAB ontwikkelen zijn echter gemiddeld ongeveer 40 jaar en met deze 40 jaar is de gemiddelde leeftijd waarop ADPKD patiënten een SAB krijgen 10 jaar lager dan patiënten zonder ADPKD.13Het op tijd opsporen en onschadelijk maken van intracraniële aneurysmata is dus essentieel voor ADPKD patiënten, waarbij we in de richtlijn aanhouden dat screening kan worden opgestart nadat de diagnose ADPKD gesteld is en vanaf de leeftijd van 20 jaar als de diagnose ADPKD jonger gesteld is. Overigens is voor het vrouwen met ADPKD en zwangerschapswens van belang om, indien screening gewenst is, dit dan te doen voorafgaand aan een eventuele zwangerschap. Er kan dan door een multidisciplinair team een beleid gemaakt worden ten aanzien van het aneurysma voorafgaand aan zwangerschap en eventuele bevalling.
Tot welke leeftijd moet worden doorgegaan met screening?
Opnieuw nemen we in deze richtlijn het advies over van de nationale richtlijn ‘ongeruptureerd intracranieel aneurysma’ wat betreft patiënten met een positieve familiegeschiedenis voor SAB. Daarin wordt geadviseerd patiënten te screenen tot de leeftijd van 75 jaar.9 In de beslissing om screening aan te bieden moet vanzelfsprekend altijd de klinische conditie van de patiënt worden meegewogen. Indien de patiënt niet (meer) in staat is om een electieve behandeling onder algehele narcose te ondergaan, moet ook screening niet worden aangeboden.
Is het mogelijk te stoppen met het maken van herhaalscans na een bepaald aantal negatieve scans?
Deze richtlijn stelt voor om patiënten gedurende een groot deel van hun leven te vervolgen, namelijk over een tijdspanne van 55 jaar. Men kan zich afvragen of het noodzakelijk is om gedurende al deze jaren elke 5 jaar een nieuwe scan te maken. Het is echter op dit moment niet bekend of een bepaald aantal negatieve scans de kans verkleint op het nieuw ontstaan van een intracranieel aneurysma. Eerder onderzoek in personen uit de algemene bevolking met een verhoogd familiair risico liet zien dat aneurysmata gevonden werden bij 51 (11%, CI 9-14) van de 458 personen die voor het eerst werden gescreend, bij 21 (8%, 5-12) van de 261 personen bij 2e screening en bij 7 (5%, 2-11) van de 128 personen bij de 3e screening en bij 3 (5%, 1-14) van de 63 bij de 4e screening. Ook bij de 3escan worden toch nog aneurysmata bij 5% van de aanvankelijk negatieve patiënten aneurysmata gevonden.27 Voor ADPKD patiënten zijn er slechts enkele studies gedaan naar het ontstaan van de novo aneurysmata. Ook deze studies lijken aan te tonen dat voor ADPKD patiënten geldt dat nieuwe intracraniële aneurysmata kunnen ontstaan op elk moment van het leven.28,29 Dit gegeven ondersteunt de aanbeveling levenslang door te gaan met screenen.
Indicatie voor screening
Deze richtlijn pleit ervoor screening aan te bieden aan elke volwassen ADPKD patiënt met een voorgeschiedenis van of familiair risico voor aanwezigheid van een intracranieel aneurysma, die hier geen contra-indicaties voor heeft (Tabel 1). Een familiair risico wordt dan gedefinieerd als het voorkomen van een bekend intracranieel aneurysma, een aneurysma ruptuur of een SAB dan wel vermoeden op een SAB (plotse dood, intracraniële bloeding van onbekende origine) bij een 1e– of 2e-graads familielid. Ook moet screening worden aangeboden aan ADPKD patiënten met een hoog risico beroep (dat wil zeggen, hoog risico voor veiligheid van ook anderen op moment van SAB), zoals een piloot, een buschauffeur. Belangrijk te vermelden dat in deze groep enerzijds het risico voor anderen maakt dat screening aanbieden essentieel is, anderzijds heeft het hebben van een aneurysma in deze groep ook extra consequenties met betrekking tot bijvoorbeeld groot rijbewijs, vliegbrevet, etc. Counseling van de patiënt over de voor- en nadelen voorafgaand aan de keuze voor screening is hierbij essentieel (zie volgende paragraaf).
Overigens, indien er wordt gekozen voor screening, is het verstandig dit te doen voor een eventuele bevalling. Bij aanwezigheid van een intracranieel aneurysma, kan er door een multidisciplinair team een beleid gemaakt worden voor de bevalling.
ADPKD patiënten zonder positieve familie anamnese of voorgeschiedenis kan screening worden aangeboden indien bijvoorbeeld de patiënt hier expliciet om verzoekt. De bewijsvoering van het nut hiervan is zwakker (zie voorgaande paragraaf).
De eerste keus voor beeldvorming is time of flight MR-angiografie. Dit is een beeldvormende techniek waarbij geen contrastvloeistof hoeft worden toegediend. De tweede keus is CT-angiografie. In het geval een CT-angiografie wordt overwogen als screeningsmodaliteit, omdat een MRA gecontra-indiceerd is, moet rekening worden gehouden met de nierfunctie. Bij patiënten met een nierfunctie (eGFR) lager dan 30 mL/min/1.73m2, moeten de voordelen van screening worden afgewogen tegen het mogelijk nadelige effect van contrastvloeistof op de nierfunctie. Contra-indicaties voor screening staan in tabel 1. Contra-indicaties voor MRI as screeningsmodaliteit zijn onder andere aanwezigheid van metaal in het lichaam en zullen per centrum en MRI vastgelegd zijn. Derhalve vallen deze buiten bestek van deze richtlijn.
|
Tabel 1 Indicaties en contra-indicaties voor screening |
|
|
Indicatie voor screening |
Contra-indicaties voor screening |
|
ADPKD patiënten die 1. een positieve familie anamnese hebben wat betreft een intracranieel aneurysma* |
Leeftijd lager dan 20 jaar |
|
2. een bekend intracranieel aneurysma hebben |
Leeftijd hoger dan 75 jaar |
|
3. een hoog risico beroep hebben
|
Klinische conditie van patiënt staat electieve behandeling van het intracranieel aneurysma niet toe, omdat de risico’s van behandeling (onder algehele anesthesie) niet (langer) opwegen tegen het ruptuurrisico van een intracranieel aneurysma |
|
4. een uitdrukkelijke wens tot screening hebben |
|
* hieronder valt het voorkomen van een bekend intracranieel aneurysma, een aneurysma ruptuur of een subarachnoidale bloeding (SAB) dan wel vermoeden op een SAB (plotse dood, intracraniele bloeding van onbekende origine) bij een 1e of 2e graads familielid.
Verstrekken van informatie voorafgaand aan start screening
Het is zeer belangrijk om vóór het starten van screening een patiënt te informeren over de mogelijke voor- en nadelen van screening (Tabel 2). Het belangrijkste voordeel is dat screening een mogelijkheid biedt een intracranieel aneurysma op te sporen en te behandelen, waarmee een SAB kan worden voorkomen. Echter, er zijn ook verschillende nadelen die van tevoren met een patiënt moeten worden doorgenomen, om verrassingen later in het proces te voorkomen.
Ter voorbereiding op dit counselingsgesprek kan geschreven informatie worden toegestuurd aan een patiënt. Een voorbeeld van een dergelijke informatiefolder is bijgevoegd als bijlage aan deze richtlijn (Screening op verwijding van de hersenbloedvaten bij patiënten met autosomaal dominante polycysteuze nierziekte).
|
Tabel 2 Voor- en nadelen van screening |
|
Voordelen |
|
Voorkomen van neurologische schade door een SAB door middel van een electieve behandeling van het intracranieel aneurysma. |
|
Nadelen |
|
Kans op complicaties van de behandeling (neurochirurgisch clippen of endovasculair coilen). Risico op een complicatie van clippen is ongeveer 8% en voor coilen ongeveer 4% in de algemene populatie, niet de ADPKD populatie specifiek. In deze cijfers zijn zowel tijdelijke als blijvende schade meegenomen. |
|
Vaak is het (nog) niet nodig om een intracranieel aneurysma te behandelen, omdat het ruptuurrisico als laag wordt ingeschat. Bij kleine aneurysmata weegt het ruptuur risico niet op tegen het complicatie risico van een ingreep. In dat geval worden vervolgscans gemaakt om eventuele groei vast te stellen. In het geval blijkt dat er sprake is van groei, is dit indicatief voor een verhoogd risico op ruptuur, en zal behandeling heroverwogen worden. Het psychische effect van het weten dat er een intracranieel aneurysma is, kan een nadelig effect hebben op de gemoedsrust en levenskwaliteit |
|
Kans op toevalsbevindingen, zoals witte stofafwijkingen, arachnoïdale cysten en (benigne) tumoren |
|
Het vinden van een intracranieel aneurysma heeft gevolgen voor patiënten die een groot rijbewijs nodig hebben voor hun beroep (groep 2, rijbewijzen van de categorieën C en D). Ook heeft het gevolgen voor het verkrijgen en behouden van een vliegbrevet. |
|
Screening heeft als doel de kans op een SAB te verlagen, maar dit risico wordt hierdoor niet geheel weggenomen. Tussen twee screeningsmomenten kan een nieuw intracranieel aneurysma ontstaan, die kan knappen. |
Interpretatie van beeldvorming
De beelden van de MR- of CT-angiografie moeten bij voorkeur worden beoordeeld door een ervaren specialist, bij voorkeur door een neuroradioloog.
Follow-up
Indien de scan geen aneurysma toont, wordt aangeraden elke 5 jaar een nieuwe scan te maken, rekening houdend met de contra-indicaties die staan weergegeven in Tabel 1, tot de leeftijd van 75 jaar is bereikt (Tabel 3).
Indien de scan een aneurysma toont, moet een behandelplan worden opgesteld. Hiervoor wordt de casus idealiter besproken in een multidisciplinair overleg, waarbij onder andere neurochirurg, neuroloog en neuro-interventieradioloog aanwezig zijn. Behandeling kan bestaan uit een interventie, neurochirurgisch of endovasculair. In de meeste gevallen wordt gekozen voor een afwachtend beleid met reguliere beeldvorming (watchful waiting). Follow-up van patiënten met een aangetoond intracranieel aneurysma volgt via de neurologie of neurochirurgie. De intervallen waarmee patiënt vervolgscans krijgt, wordt bepaald door de behandelend neuroloog of neurochirurg en valt buiten bestek van deze richtlijn.
|
Tabel 3. Screeningsinterval |
|
|
Uitslag beeldvorming |
Screening interval |
|
Geen intracranieel aneurysma aangetoond |
Elke 5 jaar |
|
Intracranieel aneurysma aanwezig |
Interval wordt bij voorkeur vastgesteld in een multidisciplinair overleg en geeffectueerd door de behandelend neuroloog of neurochirurg |
Voorstel voor taakverdeling tussen de betrokken disciplines
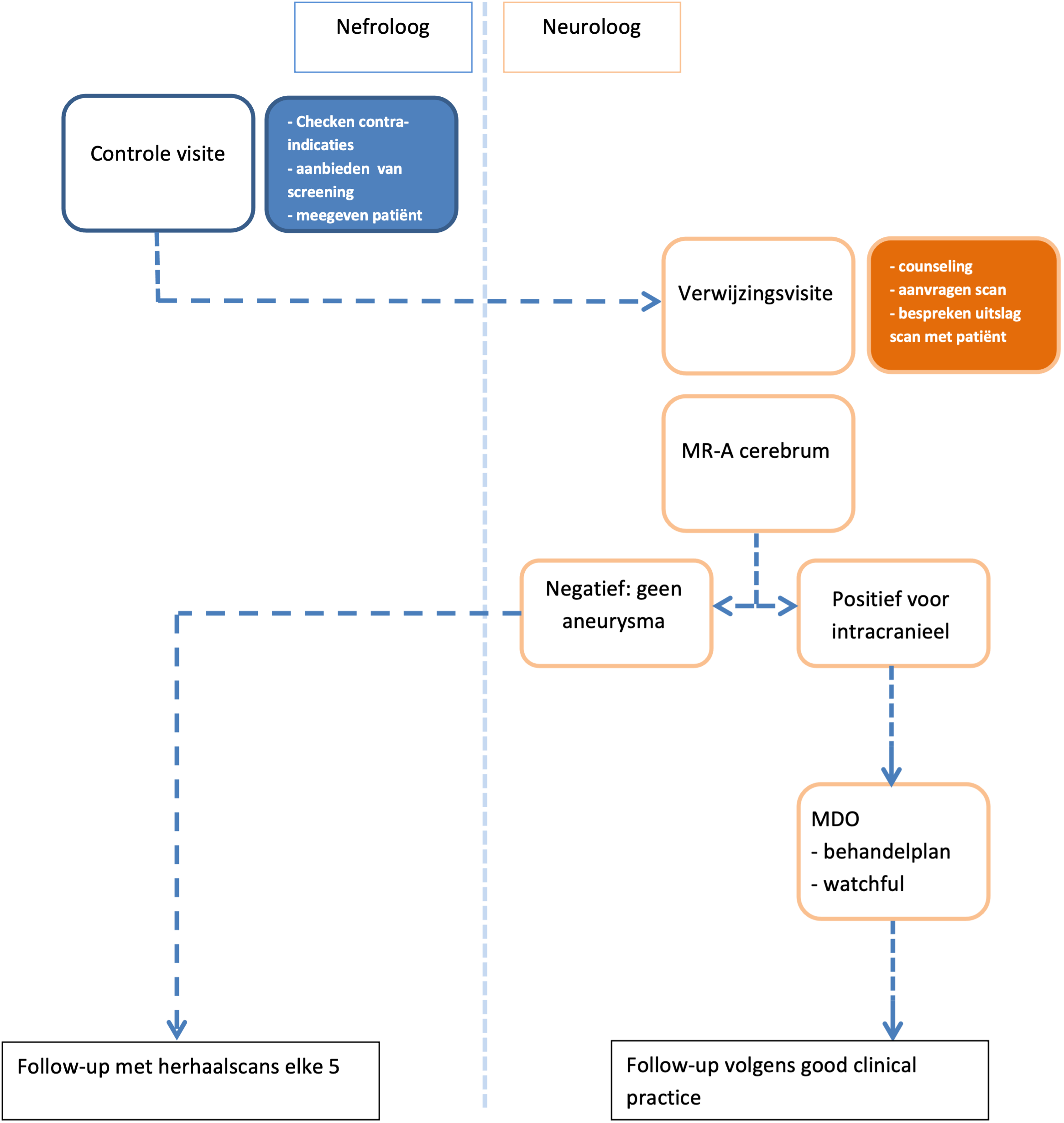
Bij uitvoering van dit screeningsprotocol komen verschillende verantwoordelijkheden kijken: het beoordelen van de contra-indicaties voor screening, het benaderen van de patiënten voor deelname aan screening, het voeren van een counselingsgesprek, correcte interpretatie van de scanresultaten en het verwittigen van de patiënt van de uitslag van de scan. Deze taken kunnen tussen de nefroloog en neuroloog verdeeld worden. De verdeling van deze taken zal binnen een ziekenhuis in overleg met beide vakgroepen gemaakt moeten worden. Deze richtlijn adviseert dat de nefroloog met ADPKD patiënten het onderwerp screening voor cerebrale aneurysmata bespreekt en om patiënten waarbij er een indicatie is voor screening te verwijzen voor een counselingsgesprek bij een neuroloog met ervaring op het gebied van vasculaire neurologie (Figuur 1, zie volgende pagina).
Ook de follow-up strategie moet binnen de eigen organisatie worden besproken. Follow-up kan zowel door de neuroloog als nefroloog worden uitgevoerd. Als een patiënt regelmatig zijn eigen nefroloog ziet in verband met zijn nierziekte, is het te overwegen de verantwoordelijkheid voor het aanvragen van een herhaalscan bij de nefroloog te laten rusten. In het geval er dan geen intracranieel aneurysma gevonden wordt, kan deze uitslag door de nefroloog worden besproken met patiënt. Indien er wel een intracranieel aneurysma gevonden wordt (of een toevalsbevinding die verdere aandacht behoeft), kan de patiënt verwezen worden naar de vasculair neuroloog.
Figuur 1. Voorbeeld van de taakverdeling tussen neuroloog en nefroloog
Onderbouwing
De bewijskracht van de beschikbare literatuur is laag. Er zijn geen randomized controlled trials verricht die de verschillende screeningsmodaliteiten met elkaar vergelijken. De aanbevelingen die in deze richtlijn zijn opgenomen, zijn vastgesteld op basis van expert opinion en simulatiestudies.
Literatuurlijst
Screening op verwijding van de hersenbloedvaten bij patiënten met cystenieren (autosomaal dominante polycysteuze nierziekte)
Waarom krijgt u deze folder?
Met de informatie in deze folder kunt u beslissen of u wel of geen scan wilt laten doen naar een aneurysma van een bloedvat in de hersenen.
Uit onderzoek blijkt dat patiënten met autosomaal dominante polycysteuze nierziekte een verhoogde kans hebben op het krijgen van een plaatselijke verwijding van een slagader in de hersenen. Zo’n uitstulping van de wand van een bloedvat heet ook wel een aneurysma. Patiënten merken meestal niet dat zij een aneurysma in de hersenen hebben, want het geeft maar zelden klachten.
Van de mensen zonder cystenieren, heeft ongeveer 3 % (3 van de honderd personen) een aneurysma van een hersenbloedvat als ze 50 jaar oud zijn. Bij mensen met cystenieren ligt dit aantal hoger. Dan komt het bij ongeveer 10 % voor (10 van de honderd personen). Als één van uw familieleden met cystenieren ook een hersenaneurysma heeft dan neemt kans toe tot meer dan 20% (20 van de honderd personen).
Als bij een patiënt een aneurysma wordt gevonden, veroorzaakt dit meestal gedurende het leven geen klachten. Maar in sommige gevallen wordt het aneurysma steeds groter en kan uiteindelijk bloeden. Dan ontstaat een hersenbloeding. Een hersenbloeding kan worden voorkomen door een aneurysma op tijd op te sporen en te behandelen. Daarom worden met u de voor- en nadelen besproken. Wilt u wel of niet uw hoofd laten scannen om vast te stellen of er een aneurysma is.
Wat zijn de voor- en nadelen van screening?
Het belangrijkste voordeel van screening, is om een hersenaneurysma op tijd op te sporen en te behandelen.
Er zijn ook een aantal nadelen aan de screening:
Hoe werkt het?
Als u zich wilt laten screenen, wordt u verwezen naar de neuroloog. Dit is een specialist op het gebied van de hersenen. Die vertelt u wat de voor- en nadelen van de screening zijn en bespreekt met u wat dat voor u betekent en wat u zelf wilt. Daarna kunt u samen met uw dokter beslissen of u wel of geen scan wilt.
Als u een scan wilt, dan is dat meestal een MRI-scan. Daarmee kunnen we de bloedvaten in de hersenen goed zien. Dit onderzoek duurt ongeveer 30 minuten. Na het onderzoek belt de neuroloog u voor de uitslag of vertelt u die tijdens een afspraak.
Geen aneurysma?
Als we geen aneurysma zien op de scan, dan maken we na ongeveer 5 jaar een nieuwe scan. U kunt voor het plannen van die afspraak zelf contact opnemen.
Wel een aneurysma?
Als we wel een aneurysma bij u vinden, bespreekt de neuroloog de vervolgstappen met u. Samen met andere in aneurysma gespecialiseerde zorgverleners maakt uw arts een behandelplan op maat. Afhankelijk van de plek en grootte kan ervoor gekozen worden het aneurysma onschadelijk te maken. Dit kan tegenwoordig op grofweg 2 manieren worden bereikt: 1) clipping, dat wil zeggen het plaatsen van een klemmetje op de basis van het aneurysma; hiervoor is het noodzakelijk de schedel open te maken, en 2) coiling, het langs endovasculaire weg dichtstoppen van het aneurysma met behulp van flexibele platina spiraaltjes (coils). Beide behandelingen vinden plaats onder narcose, en veelal verblijven de patiënten in de acute fase van de opname en behandeling op de afdeling neurologie. De keuze van de behandeling, clippen of coilen, is van verschillende factoren afhankelijk. Het is overigens niet altijd nodig om een aneurysma meteen te behandelen. Soms zijn de risico’s van het clippen of coilen groter dan de kans op het knappen van het aneurysma. Vaak is er dan wel extra controle nodig. Uw neuroloog bespreekt met u hoe vaak dit nodig is.
Kosten deelname screening
Uw zorgverzekeraar vergoedt de kosten voor de screening. Indien uw eigen risico al gebruikt is, krijgt u hiervan geen rekening.
Hoe verder?
Wilt u zich laten screenen? Dan kunt u dat aangeven bij uw volgende afspraak. We zorgen er dan voor dat u een afspraak krijgt met een van onze neurologen.
Extra informatie
Kijk voor meer informatie over aneurysma van de hersenbloedvaten op:
Kijk voor meer informatie over cystenieren op:
© 2022. Alle rechten voorbehouden