NFN glomerulonefritis hoofdstuk 3: membraneuze glomerulonefritis
Autorisatiedatum: 01-01-2023
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
Gebaseerd op hoofdstuk 3 “membranous nephropathy” van KDIGO glomerular diseases uit 2021.
Nederlandse NFN richtlijn is als volgt opgebouwd:
Auteurs
Mw. dr. A (Anne-Els) van de Logt (Anne-Els.vandeLogt@radboudumc.nl)
Prof. dr. JFM (Jack) Wetzels (Jack.wetzels@radboudumc.nl)
Verantwoordelijk lid van de Richtlijnencommissie NFN
Dr. H.W. (Henk) van Hamersvelt, Henk.vanhamersvelt@radboudumc.nl
Geen belangenverstrengeling.
Practice point 3.1.1: A kidney biopsy is not required to confirm the diagnosis of membranous nephropathy (MN) in patients with nephrotic syndrome and a positive anti-PLA2R antibody test.
Onderbouwing
De aanwezigheid van anti-PLA2R antistoffen (aPLA2Rab) in het bloed is voldoende voor het stellen van de diagnose membraneuze nefropathie (MN). De richtlijn geeft wel aan dat er situaties zijn waarin wel een nierbiopsie moet overwogen, met name om andere oorzaken van onverwacht nierfunctieverlies op te sporen.
Commentaar
Het is goed om te weten dat bij patiënten met een door aPLA2Rab veroorzaakte MN in de vroege fase antistoffen in het bloed kunnen ontbreken.
Bij atypische presentatie, atypisch beloop en/of onvoldoende respons op gebruikelijke therapie is er wel een indicatie voor een nierbiopt, dat andere relevante informatie kan opleveren:
Practice point 3.1.2: Patients with MN should be evaluated for associated conditions, regardless of whether anti-PLA2R antibodies and/or anti-THSD7A antibodies are present or absent (Figure 29).
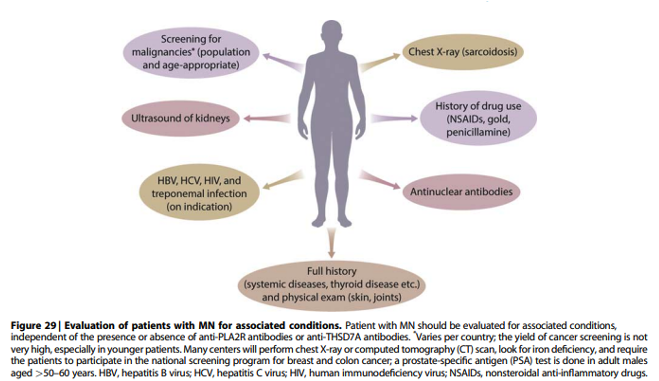
Onderbouwing
Anti-PLA2R antistoffen zijn specifiek voor de diagnose MN. Maar de aanwezigheid van deze antistoffen maakt het niet mogelijk om met voldoende zekerheid onderscheid te maken tussen een primaire MN of een secundaire MN. Met name bij patiënten met een hepatitis B/C en sarcoïdose zijn aPLA2Rab aangetoond. Hepatitis B en C serologie en een X-thorax behoren dan ook in Nederland tot de routine aanbevolen screening. HIV en lues serologie alleen op indicatie.
Het is bekend dat er een associatie is tussen MN en een onderliggende maligniteit. Ook bij patiënten met MN en positieve aPLA2Rab zijn maligniteiten aangetoond, alhoewel de studies suggereren dat dit waarschijnlijk meestal berust op een toevallige associatie en niet op causaliteit. Toch adviseert de richtlijn om bij patiënten met aPLA2Rab positieve MN de gebruikelijk screening aan te houden (naast de bovengenoemde X thorax, ook PSA bij mannen > 50 jaar, deelname bevolkingsonderzoek, en eventueel aanvullend onderzoek op basis van gevonden lab-afwijkingen zoals ijzergebrek).
Commentaar
De richtlijn benoemt ook THSD7A antistoffen. Alhoewel de initiële studie een associatie met maligniteiten suggereerde1, werd dit in een andere studie niet bevestigd2. Het is overigens zeker zo dat bij sommige patiënten met THSD7A antistoffen er een causaal verband lijkt te zijn, met name in die gevallen waarbij de tumorcellen THSD7A tot expressie brengen3. Het is daarom goed om bij patiënten met een THSD7A positieve MN extra bedachtzaam te zijn.
Na het tot stand komen van de richtlijn zijn in korte tijd veel nieuwe antigenen/antistoffen ontdekt. De klinische relevantie is nog onvoldoende onderzocht en op dit moment ontbreekt de betekenis hiervan voor de klinische praktijk omdat de antistoffen niet kunnen worden aangetoond met een commerciële test. Een aantal van deze nieuwe antigenen kan met een histologische kleuring worden aangetoond maar ook deze kleuringen zijn niet routinematig beschikbaar.
Op dit moment zou alleen een histologische kleuring van het nierbiopt voor het antigeen NELL1 van klinische relevantie kunnen zijn4. Patiënten met NELL1 geassocieerde MN hebben in het bloed antistoffen tegen het antigeen. Bijzonder is wel dat deze antistoffen van de IgG1 subklasse zijn, en niet van de IgG4 subklasse zoals aPLA2Rab. Bij patiënten met een NELL1 geassocieerde MN is vaak sprake van een secundaire vorm, hetzij op basis van een maligniteit4, hetzij op basis van het gebruik van supplementen (liponzuur5 of inheemse medicijnen behorend tot de groep van de kwikbevattende ayurvedische of Siddha medicijnen6). Op dit moment is routinematige kleuring van een nierbiopt voor NELL1 helaas nog niet beschikbaar. Naar verwachting zullen de adviezen t.a.v. bepaling van antigenen/antistoffen op korte termijn aangepast moeten worden.
Practice point 3.2.1 In patients with MN, use clinical and laboratory criteria to assess the risk of progressive loss of kidney function (Figuur 30).
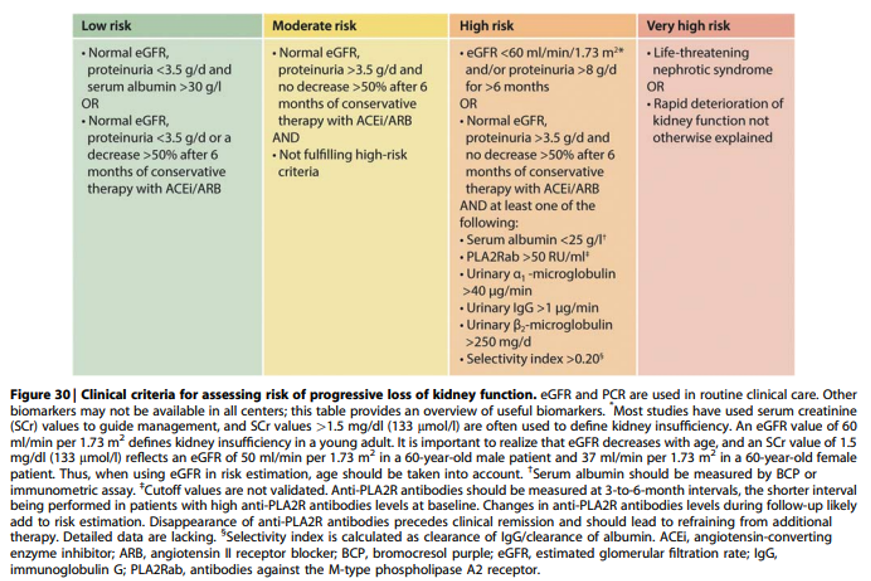
Risk assesment op baseline
Commentaar
In figuur 30 van de richtlijn wordt een indeling gemaakt van patiënten in risico categorieën op basis van “baseline” kenmerken. De richtlijn geeft duidelijk aan dat een individuele patiënt niet altijd alle kenmerken heeft van één risicocategorie. Risicostratificatie moet gezien worden als een gradueel proces, met veel overlap. In de ideale situatie zou er een risico-calculator beschikbaar moeten zijn die een risico score maakt op basis van verschillende biomarkers. Voor sommige biomarkers zijn er validatie studies gedaan en afkapwaarden gedefinieerd. Voorbeelden zijn proteïnurie van > 8 g/dag gedurende meer dan 6 maanden7, een verhoogde uitscheiding van β2m en α1m in de urine8. De AUC van deze biomarkers is echter nog verre van ideaal, met AUC’s geschat op 0.70-0.80.
In de KDIGO richtlijn wordt een cutoff aPLA2Rab titer van 50 U/ml gehanteerd om zogenaamd ‘high risk’ te definiëren. Deze cutoff is niet gevalideerd, en recente studies suggereren dat de titer van aPLA2Rab na correctie voor proteïnurie en nierfunctie nauwelijks nog voorspellende waarde heeft. Onderzoek van het Radboudumc suggereert dat een titer > 150 RU/ml meer past bij hoog risico, met nog steeds wel een kans op een spontane remissie van 20-25%9. Bij een recidief MN worden vaker lage aPLA2Rab titers gezien en moeten andere variabelen zeker worden meegewogen om tot een juiste risico inschatting te komen. Indien een ELISA test niet in het eigen centrum beschikbaar is deze test in meerdere centra worden bepaald (waaronder bij Sanquin).
Risk assesment gedurende follow-up
Onderbouwing
De richtlijn adviseert voor alle patiënten met MN en behouden nierfunctie een observatieperiode van 6 maanden met maximaal conservatieve therapie. Het beloop in deze 6 maanden moet worden meegewogen bij de risico stratificatie. Een voorbeeld is de bovengenoemde proteïnurie cutoff waarde. Indien in de observatie periode de proteïnurie daalt tot onder de 4 gram/dag, of > 50 % daalt ten opzichte van baseline moet een afwachtend beleid worden voortgezet. Indien er sprake is van achteruitgang van nierfunctie, toegeschreven aan de MN, dan is er sprake van een zeer hoog risico, en moet behandeling met immunosuppressie worden gestart.
Commentaar
De richtlijn geeft aan dat immunosuppressie kan worden gestart als er gedurende > 6 maanden sprake is van proteïnurie > 4 gram/24 uur. De meeste artsen starten met immuunsuppressieve therapie al kort na 6 maanden conservatieve therapie, met als argumentatie dat een nefrotisch syndroom op zichzelf ook bijwerkingen heeft. De RLC acht een langer afwachtend beleid gerechtvaardigd zeker als er sprake is van een matig ernstig nefrotisch syndroom omdat spontane remissies ook nog 12-36 maanden na initiële presentatie voorkomen.
Het beloop in deze fase van conservatieve therapie draagt bij aan betere risico-inschatting. Met name veranderingen in proteïnurie, serum albumine, en nierfunctie zijn relevant. Ook een herhaalde meting van de uitscheiding van laagmoleculaire eiwitten kan helpen bij de risicoschatting10. In Figuur 30 staan de afkapwaarden voor de laagmoleculaire eiwitten vermeld. Zoals hierboven besproken heeft een eenmalige meting van aPLA2Rab weinig prognostische waarde. Aanvullend onderzoek zal moeten aantonen of veranderingen in aPLA2Rab titers tijdens follow-up wel een bruikbare prognostische biomarker zijn.
Practice point 3.3.1: Considerations for treatment of patients with primary MN:
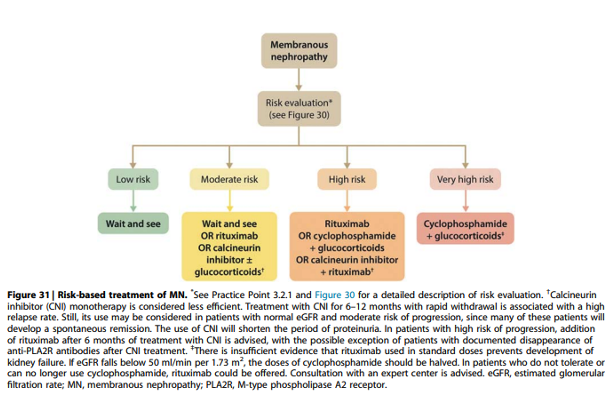
Onderbouwing
Immunosuppressieve therapie moet alleen gegeven worden aan patiënten met een risico op toekomstig nierfunctieverlies.
Practice point 3.3.2: Immunosuppressive therapy is not required in patients with MN, proteinuria < 3.5 g/d, serum albumin > 30 g/l by bromocresol purple (BCP) or immunometric assay, and eGFR > 60 ml/min per 1.73 m2.
Onderbouwing
Dit zijn patiënten zonder nefrotisch syndroom waarbij adequate follow-up volstaat. Bij ontstaan van een nefrotisch syndroom moet weer een risicoschatting worden gemaakt.
Practice point 3.3.3 Immunosuppressive therapy is not required in patients with MN, nephrotic syndrome, and normal eGFR, unless at least one risk factor for disease progression is present or serious complication of nephrotic syndrome (e.g. AKI, infections, thromboembolic events) have occurred.
Commentaar
Het beleid bij patiënten met MN wordt bepaald door de risico-inschatting enerzijds, maar ook door voorkeur van de patiënt (en de ervaring van de dokter). Bij patiënten met een nefrotisch syndroom zonder risicokenmerken (moderate risk) kan gekozen worden voor een afwachtend beleid, maar ook voor behandeling met therapie zoals rituximab of tacrolimus, waarbij de behandeling met tacrolimus gecombineerd kan worden met prednison (lage dosering). Deze combinatie is met name gegeven in Aziatische studies maar de meerwaarde van prednison is niet bewezen zodat de RLC de voorkeur geeft aan een behandeling met tacrolimus monotherapie. Tacrolimus is overigens mogelijk minder effectief bij patiënten met hoge aPLA2Rab titers op baseline (> 150 RU/ml)11. Omdat het risico op progressie bij patiënten met moderate risk relatief beperkt is, is er bij patiënten met moderate risk geen plaats voor behandeling met cyclofosfamide gedurende 6 maanden.
Het is terecht dat de richtlijn geen keuze maakt, omdat er geen bewijs is voor verschillen in effectiviteit tussen de verschillende strategieën. De RLC wil daarbij benadrukken dat bij patiënten met moderate risk, met behouden nierfunctie en behandelbaar nefrotisch syndroom, een afwachtend beleid dus overwogen kan en mag worden. Als gekozen wordt voor een behandeling, dan wordt de keuze bepaald door de bijwerkingen en bijvoorbeeld ook de mogelijkheid tot het staken van de therapie. In de covid-19 pandemie had behandeling met rituximab beperkingen, onder andere door de verminderde respons op vaccinaties. Een kortdurende behandeling met cyclofosfamide zou mogelijk nog wel een optie kunnen zijn bij patiënten met moderate risk en aantoonbare antistoffen (zie verderop). In het geval van MN zonder aantoonbare aPLA2Rab is het niet mogelijk om de behandeling te verkorten, en is er enkel plaats voor cyclofosfamide in de (very) high-risk populatie.
De KDIGO richtlijn bespreekt niet hoe patiënten met een moderate risico, die na 6 maanden onvoldoende respons op tacrolimus of rituximab tonen, moeten worden behandeld. Daarbij gaat het in eerste instantie om de klinische respons. Na verdwijnen van aPLA2Rab is er vaak een vertraging in de klinische respons welke kan variëren, maar meestal 3 tot 6 maanden achterloopt. Indien er geen klinische respons optreedt bij persisterend negatieve aPLA2Rab dan dienen de aPLA2Rab vervolgd te worden, en dient een nieuw nierbiopt te worden overwogen wanneer deze negatief blijven. Wanneer er sprake is van een fraaie klinische respons (e.g. < 1 gram/24 uur) en persisterende negatieve aPLA2Rab dient eventuele immuunsuppressie afgebouwd te worden en verder een conservatief beleid gevoerd te worden.
Patiënten met moderate risk met onvoldoende respons na 6 maanden behandeling met tacrolimus monotherapie of rituximab dienen volgens de RLC in principe beschouwd te worden als hoog-risico patiënten en suggereert om dergelijke patiënten verder te behandelen conform de schema’s voor hoog-risico patiënten. Dit betekent dat patiënten die behandeling zijn gestart met tacrolimus bij onvoldoende response na 6 maanden additionele therapie dienen te krijgen in de vorm van rituximab of cyclofosfamide. Patiënten die gestart zijn met rituximab dienen na 6 maanden een tweede reeks rituximab te ontvangen.
De richtlijn beschouwt een thrombo-embolisch event als een hoog risico kenmerk. Dit is vaak het geval, maar omdat deze patiënten al behandeld worden met anticoagulantia is het maar zeer de vraag of immuunsuppressie altijd al gestart moet worden. De RLC suggereert om ook in deze gevallen een observatieperiode aan te houden om het spontane beloop te kunnen evalueren.
Recommendation 3.3.1 For patients with MN and at least one risk factor for disease progression, we recommend using rituximab or cyclophosphamide and alternate months glucocorticoids for 6 months, or CNI-based therapy for ≥ 6 months, with the choice of treatment depending on risk estimate (Figure 30 and Figure 31) (1B).
Onderbouwing
Deze aanbeveling voor hoog-risico patiënten vervangt de aanbeveling uit de KDIGO richtlijn uit 2012. In de oude richtlijn kreeg behandeling met cyclofosfamide de voorkeur omdat dat de enige bewezen behandeling was die nierschade voorkomt. Hoewel er nog steeds geen direct bewijs is van de effectiviteit op voorkomen van nierfalen zijn er voldoende aanwijzingen voor effectiviteit van rituximab en calcineurine remmers (tacrolimus, ciclosporine) op het optreden van remissie van de proteïnurie als surrogaat marker. De bijwerkingen van cyclofosfamide wegen dan in belangrijke mate mee. De richtlijn geeft ook aan dat er verschillen in beleid zullen zijn afhankelijk van regio, vergoeding e.d. Bij de overweging om te starten met immunosuppressieve therapie dient wel rekening gehouden te worden met de leeftijd van patiënt en de levensverwachting.
Voor patiënten met een sterk verhoogd risico (de facto achteruitgang van nierfunctie of onbehandelbaar nefrotisch syndroom) blijft cyclofosfamide de eerste en enige keuze van therapie.
Commentaar
Voor patiënten met een hoog risico kan een keuze worden gemaakt uit een van de beschikbare therapieën. Hierbij moet in overleg met de patiënt een afweging worden gemaakt tussen de effectiviteit en de bijwerkingen.
Bij het maken van de keuze kan rekening gehouden worden met de volgende punten:
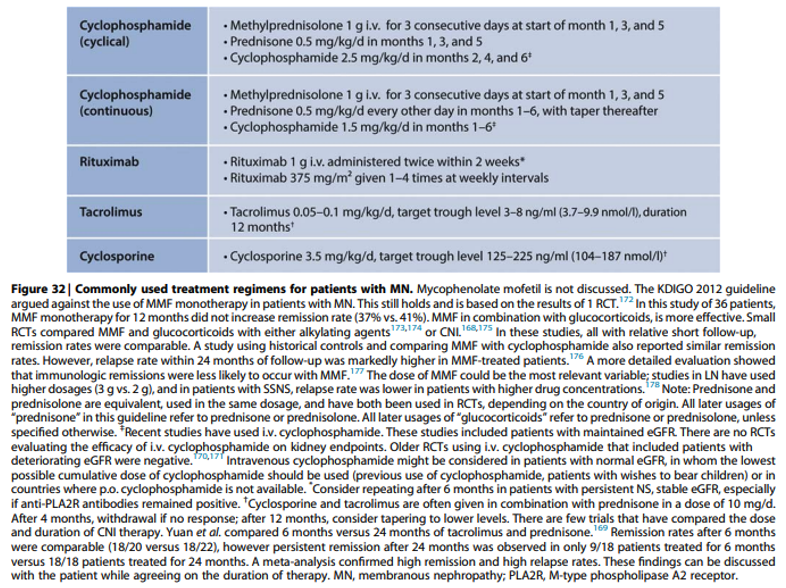
Bij het schrijven van de KDIGO richtlijn in 2021 waren gegevens over de betekenis van aPLA2Rab bij de behandeling nog niet voorhanden. Duidelijk was al wel dat een immunologische remissie een voorwaarde is voor een klinische remissie. Inmiddels is er een studie die aantoont dat een behandeling met cyclofosfamide aangepast aan de antistof respons bijdraagt aan een meer verantwoord gebruik van cyclofosfamide. In een studie waarin hoog-risico patiënten met aPLA2Rab geassocieerde ziekte werden behandeld met cyclofosfamide/prednison op geleide van de aPLA2Rab respons, kon de behandeling in ongeveer 40% van de patiënten worden verkort tot 8 weken (van de Logt, Kidney International Reports 2022, in press: https://doi.org/10.1016/j.ekir.2022.12.003).
Toekomstig onderzoek zal moeten uitwijzen of op dezelfde manier behandeling met rituximab of tacrolimus kan worden vervolgd. De effectiviteit van combinatietherapie zal ook nog moeten worden onderzocht.
De richtlijn onderstreept dat patiënten die niet reageren op de standaard therapie in aanmerking komen voor experimentele therapie in overleg met expertisecentra.
Aanvullende RLC practice points initial immunosuppressive therapy bij hoog-risico patiënten:
Practice Point 3.3.4: Longitudinal monitoring of anti-PLA2R antibody levels at 6 months after start of therapy may be useful for evaluating response in patients with MN, and can be used to guide adjustments to therapy (Figure 33).
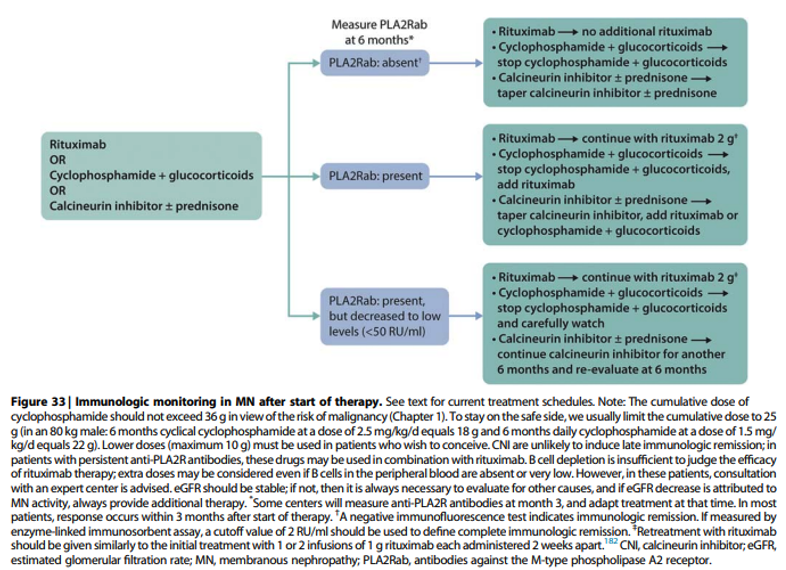
Commentaar
Op het moment van schrijven van de KDIGO richtlijn in 2021 waren hier nog geen data over. Inmiddels is duidelijk dat het herhaald meten van antistoffen kan bijdragen aan het optimaliseren van de behandeling. In het algemeen is het streven het bereiken van een immunologische remissie. Het is belangrijk te vermelden dat een ELISA titer van 2-14 RU/ml niet beschouwd kan worden als een complete immunologische respons. De RLC adviseert daarom een immunofluorescentie (IFT) test aan welke negatief dient te worden of te streven naar een ELISA titer < 2 RU/ml.
Incidenteel zijn er patiënten met een duidelijk dissociatie tussen immunologische en klinische respons (klinische remissie met persisterende antistoffen). In deze gevallen is de klinische respons leidend.
In Figuur 33 staat aangeven dat na verdwijnen van aPLA2Rab na 6 maanden behandeling met tacrolimus +/-prednison, kan worden overwogen om de tacrolimus (en prednison) af te bouwen. De RLC suggereert om de behandeling met tacrolimus monotherapie langer te continueren (2 jaar, inclusief tapering) vanwege het hoge aantal recidieven. Indien de anti-PLA2R antistoffen na 6 maanden nog aanwezig zijn (IFT positief of ELISA > 2 RU/ml) adviseert de RLC om rituximab 1000 mg intraveneus toe te voegen en in 3 maanden tijd de tacrolimus af te bouwen. Indien de anti-PLA2R antistoffen na 3 maanden verdere follow-up nog aanwezig zijn in een lage titer (>2 en < 50 RU/ml), en er geen sprake is van een complete remissie, onderschrijft de RLC het KDIGO advies om de rituximab infusen te herhalen.
Wanneer de anti-PLA2R antistoffen na 6 maanden behandeling met cyclofosfamide en prednisolon nog aanwezig zijn adviseert de RLC om bij het persisteren van een relevante hoeveelheid proteïnurie (> 1 gram/24 uur) de cyclofosfamide te vervangen door mycofenolzuur (MMF)/prednisolon of rituximab tot het bereiken van een immunologische remissie.
Practice point 3.4.1: Algorithm for the treatment of patients with MN and initial relapse after therapy (Figure 34).
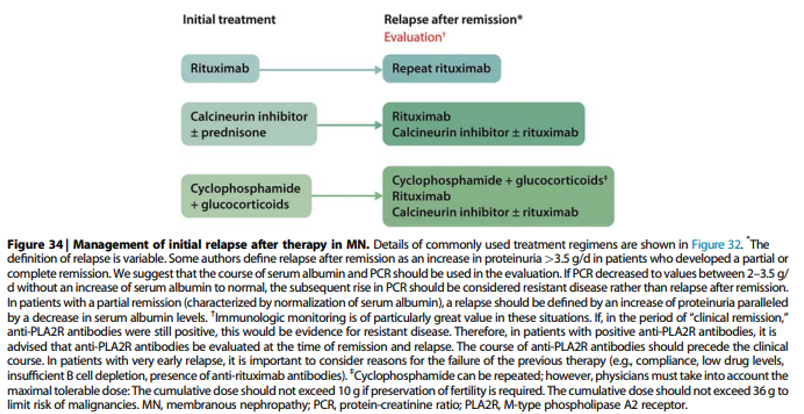
Commentaar
Ook bij een recidief (al dan niet na behandeling met immuunsuppressieve therapie) dient allereerst, in geval van een stabiele nierfunctie, middels optimaliseren van de conservatieve therapie te worden afgewacht of er een spontane remissie optreedt. Zeker wanneer het recidief > 2 jaar optreedt na het staken van de initiële behandeling kan een observatie periode van 6-12 maanden (en mogelijk langer) in acht worden genomen. De bovengenoemde RLC practice points die gelden voor de initiële behandeling zijn hier ook van toepassing. Indien er sprake is van een sneller recidief kan, afhankelijk van de initiële behandeling, bij voorkeur in overleg met een expertise centrum voor worden gekozen om patiënt eerder te behandelen. Overleg met expertisecentrum wordt ook geadviseerd wanneer de maximale cumulatieve dosering cyclofosfamide is overschreden (35 gram cyclofosfamide, of in geval van wens tot behoud van fertiliteit 10 gram cyclofosfamide).
De terugkeer van aPLA2Rab en een klinisch recidief lopen vaak niet parallel. Wanneer er enkel sprake is van terugkeer van aPLA2Rab en er sprake is van proteïnurie in de niet-nefrotische range, dan is een conservatief beleid gerechtvaardigd. Soms is er sprake van een passagère fenomeen, bijvoorbeeld na het doormaken van infecties zoals influenza en/of na vaccinatie. Er zijn ook situaties waarbij in het geval van een PLA2R-gerelateerde MN de aPLA2Rab bij een recidief (ook na een langere observatie tijd) niet aantoonbaar zijn. In dit geval dient (herhaling van) een nierbiopt te worden overwogen ten einde uit te wijzen of er nog steeds sprake is van MN, of dat er misschien sprake is van een andere ziekte.
Practice point 3.4.2: Algorithm for management of patients with treatment-resistant MN (Figure 35).
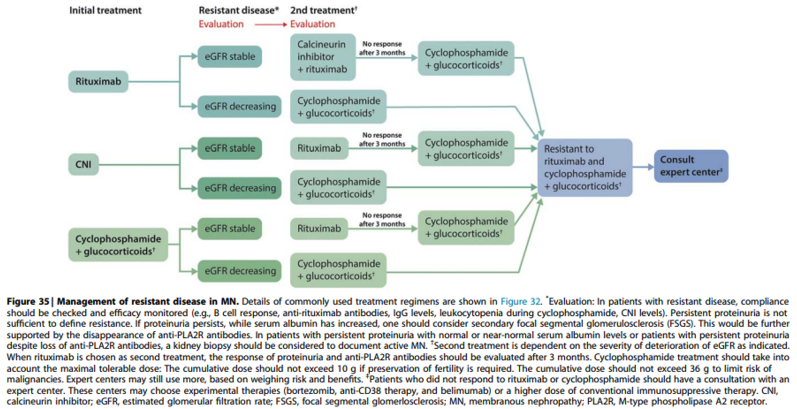
Commentaar
Zoals in de tekst staat aangegeven is er geen universeel geaccepteerde definitie van ‘resistente ziekte’. Wanneer er sprake is van onveranderd en/of persisterend (hoge) aPLA2Rab na een adequate duur en dosering van 1e-lijns immunosuppresieve therapie is er volgens de KDIGO richtlijn sprake van ‘resistente ziekte’. Aangezien bekend is dat tacrolimus vaak niet effectief is bij patiënten met hoge aPLA2Rab titers op baseline (> 150 U/ml) en rituximab niet toereikend is bij 35 % van de MN patiënten, betekent ‘resistent’ volgens de RLC dat er tenminste een optimale behandeling met cyclofosfamide en prednison moet zijn gegeven (e.g. maximaal 35 gram cyclofosfamide, of in geval van wens tot behoud van fertiliteit maximaal 10 gram cyclofosfamide in combinatie met rituximab infusen). In voorkomende gevallen is overleg met een expertisecentrum zinvol om te overleggen of patiënt in aanmerking komt voor behandeling met nieuwere medicatie zoals obinituzimab en antiplasmacel therapie bij voorkeur in studieverband en uiteraard alleen pas na uitgebreide toelichting aan en toestemming van de patiënt voor deze nog niet bewezen behandelingen.
Practice point 3.4.3: Evaluation of a kidney transplant recipient with MN (Figure 36).
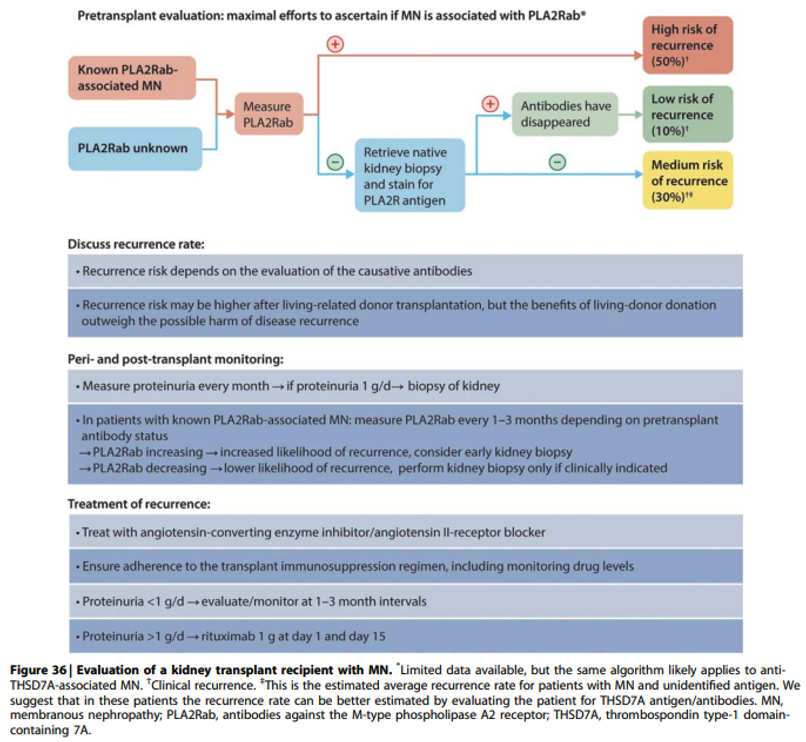
Onderbouwing
Een PLA2R kleuring op het nierbiopt van patiënten met negatieve anti-PLA2R antistoffen is noodzakelijk wanneer bij hen ook in het verleden niet bekend is of ze ooit anti-PLA2R antistoffen hebben gehad. Deze informatie draagt bij aan goede counseling over het recidief risico na transplantatie. Er is een hoog risico op een recidief in de transplantaatnier indien de anti-PLA2R antistoffen nog in het serum aantoonbaar zijn. Er is geen rol voor behandeling van deze antistoffen voorafgaande aan de transplantatie. Door nauwkeurige monitoring van proteïnurie en aPLA2Rab na transplantatie is een recidief in een vroege fase te detecteren en goed te behandelen (met rituximab). Derhalve heeft een levende donor transplantatie de voorkeur. Mycofenol mofetil (MMF) is vermoedelijk beter dan een CNI post-transplantatie ter reductie van aPLA2Rab.
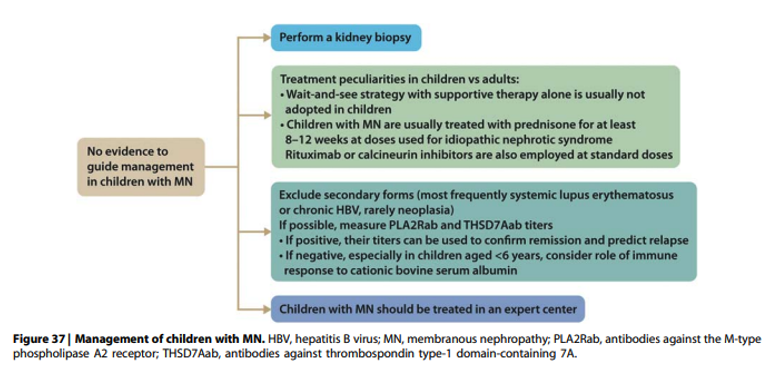
Practice point 3.4.3: Algorithm for management of children with MN (Figure 37).
Practice point 3.4.5: Prophylactic anticoagulant therapy in patients with MN and nephrotic syndrome should be based on an estimate of the risk of thrombotic events and the risk of bleeding complications (Figure 38).
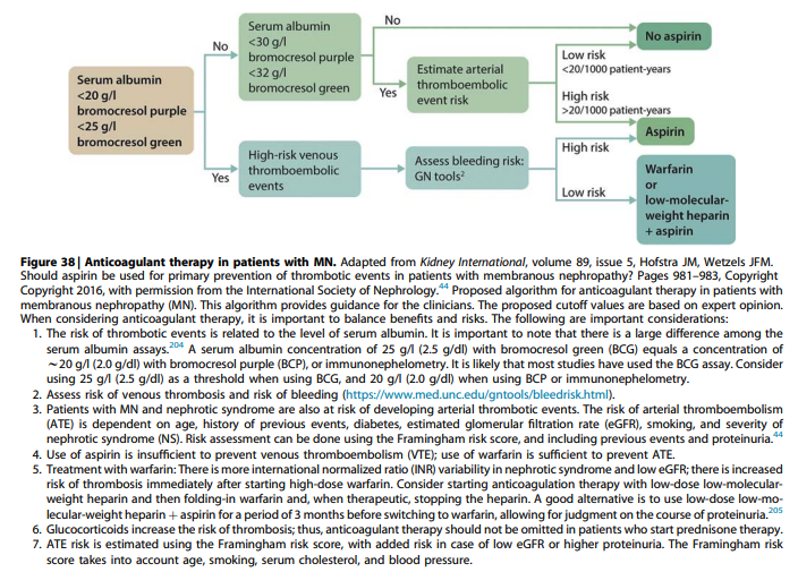
Commentaar
De beslissing om te starten met anticoagulantia wordt in belangrijke mate bepaald door het serum albumine gehalte. Er zijn grote verschillen tussen de bepalingen. Met name de BCG bepaling vertoont grote afwijkingen, waarbij er vaak een systemische deviatie is van > 5 gram/l (onderzoek Radboudumc met 5 centra bias 6.2 g/l, SD 2.4 g/l)13. De BCP bepaling heeft weinig bias (0.3 g/l, SD 1.5 g/l). Helaas is er geen systematisch verschil voor alle BCG bepalingen (data Radboudumc, submitted to Clinical Chemistry jan 2023) waardoor een eenvoudige correctiefactor niet mogelijk is. Daarom moet lokaal gekeken worden naar de mate van bias (afhankelijk van gebruikt platform). De RLC adviseert om de in de richtlijn genoemde cutoff waardes voor albumine te gebruiken, en daarbij rekening te houden met de afwijkingen in het lokale lab.
Zie verder advies over al dan niet starten van anticoagulantie en/of acetylsalicylzuur hoofdstuk 1, onderdeel 1.7 “hypercoagulability and thrombosis
Relevant: de richtlijn benadrukt dat het geven van DOAC als profylaxe bij patiënten met nefrotisch syndroom onvoldoende is onderzocht.
1. Hoxha E, Beck LH, Jr., Wiech T, Tomas NM, Probst C, Mindorf S, et al. An Indirect Immunofluorescence Method Facilitates Detection of Thrombospondin Type 1 Domain-Containing 7A-Specific Antibodies in Membranous Nephropathy. J Am Soc Nephrol. 2017;28(2):520-31.
2. Zaghrini C, Seitz-Polski B, Justino J, Dolla G, Payre C, Jourde-Chiche N, et al. Novel ELISA for thrombospondin type 1 domain-containing 7A autoantibodies in membranous nephropathy. Kidney Int. 2019;95(3):666-79.
3. Hoxha E, Wiech T, Stahl PR, Zahner G, Tomas NM, Meyer-Schwesinger C, et al. A Mechanism for Cancer-Associated Membranous Nephropathy. N Engl J Med. 2016;374(20):1995-6.
4. Sethi S, Debiec H, Madden B, Charlesworth MC, Morelle J, Gross L, et al. Neural epidermal growth factor-like 1 protein (NELL-1) associated membranous nephropathy. Kidney Int. 2020;97(1):163-74.
5. Spain RI, Andeen NK, Gibson PC, Samuels MH, Morris CD, Solomon AJ, et al. Lipoic acid supplementation associated with neural epidermal growth factor-like 1 (NELL1)-associated membranous nephropathy. Kidney Int. 2021;100(6):1208-13.
6. Kurien AA, Prema Ks J, Walker PD, Caza TN. Traditional indigenous medicines are an etiologic consideration for NELL1-positive membranous nephropathy. Kidney Int. 2022;102(6):1424-6.
7. Cattran DC, Pei Y, Greenwood CM, Ponticelli C, Passerini P, Honkanen E. Validation of a predictive model of idiopathic membranous nephropathy: its clinical and research implications. Kidney Int 1997;51(3):901-7.
8. van den Brand JA, Hofstra JM, Wetzels JF. Low-molecular-weight proteins as prognostic markers in idiopathic membranous nephropathy. Clin J Am Soc Nephrol. 2011;6(12):2846-53.
9. Logt AV, Justino J, Vink CH, van den Brand J, Debiec H, Lambeau G, et al. Anti-PLA2R1 Antibodies as Prognostic Biomarker in Membranous Nephropathy. Kidney Int Rep. 2021;6(6):1677-86.
10. Hofstra JM, Wetzels JF. Management of patients with membranous nephropathy. Nephrol Dial Transplant 2012;27(1):6-9.
11. Wang B, Zhu Z, Huang F, Huang H, Tu L, Wang Y, et al. Anti-phospholipase A2 receptor antibody levels at diagnosis predicts outcome of TAC-based treatment for idiopathic membranous nephropathy patients. BMC Nephrol. 2022;23(1):306.
12. van de Logt AE, Dahan K, Rousseau A, van der Molen R, Debiec H, Ronco P, et al. Immunological remission in PLA2R-antibody-associated membranous nephropathy: cyclophosphamide versus rituximab. Kidney Int. 2018;93(4):1016-7.
13. van de Logt AE, Rijpma SR, Vink CH, Prudon-Rosmulder E, Wetzels JF, van Berkel M. The bias between different albumin assays may affect clinical decision-making. Kidney Int. 2019;95(6):1514-7.
© 2022. Alle rechten voorbehouden