NFN richtlijn membranoproliferatieve glomerulonefritis (MPGN)
Autorisatiedatum: 01-12-2024
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
KDIGO guideline glomerulaire ziekten 2021, hoofdstuk 8 immuunglobuline- of complement-gemedieerde glomerulaire ziekte met membrano-proliferatieve glomerulonefritis (MPGN) patroon van schade
Verantwoordelijk lid van de Richtlijnencommissie NFN:
Dr. H.W. (Henk) van Hamersvelt
Geen belangenverstrengeling
Gebaseerd op hoofdstuk 8 “Immunoglobulin- and complement-mediated glomerular diseases with a membranoproliferative glomerulonephritis (MPGN) pattern of injury” van KDIGO glomerular diseases uit 2021(1) en aangevuld met gegevens/figuren uit de recentere ERA Neph-Manual uit 2023(2).
Nederlandse NFN richtlijn is als volgt opgebouwd:
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van een goede zorg voor de patiënt, van een richtlijn moet worden afgeweken.
Afkortingenlijst:
KDIGO Kidney Disease Improving Global Outcomes
MPGN Membrano-Proliferatieve GlomeruloNephritis
DDD Dense-Deposit Disease
HCV Hepatitis-C Virus
SLE Systemische Lupus Erythematodes
CFH Complement-Factor H.
CFHR(5) CFH-Related Proteine (5)
CFI Complement-Factor I
HUS/TTP Hemolytisch Uremisch Syndroom/Trombotische Trombocytopenische Purpura
POEMS Polyneuropathy, Organomegaly, Endocrinopathy/edema, Monoclonal protein, Skin changes
EM Electronen Microscopie
LM Licht Microscopie
ICGN Immune Complex GlomeruloNefritis
MGRS Monoclonal Gammopathy of Renal Significance
PGNMID Proliferatieve GlomeruloNephritis met Monoclonale Immuunglobuline Deposities
C3GN C3-GlomeruloNefritis
GFR Glomerulaire Filtratie Rate
De KDIGO-richtlijn 2021 vervangt die uit 2012 voor ‘idiopathische MPGN’. In de tussenliggende jaren is consensus bereikt dat MPGN niet een ziekte is, maar dat er in die gevallen sprake is van een glomerulair beschadigingspatroon, dat veroorzaakt wordt door gestoorde activatie van de alternatieve complement-route, of complement-binding door immuunglobulines via de klassieke route. De ‘nieuwe term’ C3-glomerulopathie, waaronder C3-glomerulonefritis en dense-deposit-disease (DDD), maken onderdeel uit van dit spectrum. In dit hoofdstuk wordt de diagnostiek en behandeling van deze aandoening behandeld. De behandeling van patiënten met een MPGN-achtig beschadigingspatroon dient gericht te zijn op het blootleggen van de oorzaak van immuunglobuline/complement-depositie. Die oorzaken zijn het deponeren van:
Soms kan de oorzaak van depositie van immuuncomplexen niet worden achterhaald, en voor die gevallen wordt nog de term idiopathische MPGN gereserveerd. Dit vindt vooral plaats bij kinderen, vrijwel nooit bij volwassenen. Omdat voorgaande gecontroleerde trials patiënten includeerden op basis van de nu verlaten licht-of electronen-microscopische classificatie en niet op basis van de huidige praktijk die een etiologische diagnose op basis van immunofluorescentie probeert te demaskeren, zijn er op dit moment geen van evidence-based behandeladviezen. Daarom zijn op dit moment alleen aanbevelingen op basis expert opinion (practice points) beschikbaar die kunnen helpen om klinische beslissingen te maken voor patiënten.
Lichtmicroscopisch wordt MPGN gekenmerkt door een verhoogd aantal intraglomerulaire (ontstekings)cellen en diffuse verdikking van de capillaire wand. Deze verhoogde cellulariteit ziet men ofwel mesangiaal, maar ook endocapillair. Soms worden in de lichtmicroscopie ook crescents gezien. De klinische presentatie is niet specifiek. Patiënten kunnen zich presenteren met (nefrotische range) proteïnurie, hematurie, nierfunctieverlies of hypertensie. Concentraties van C3 en C4 zijn soms wel, en soms niet verlaagd. Aandoeningen geassocieerd met MPGN staan genoemd in onderstaande figuur 68.
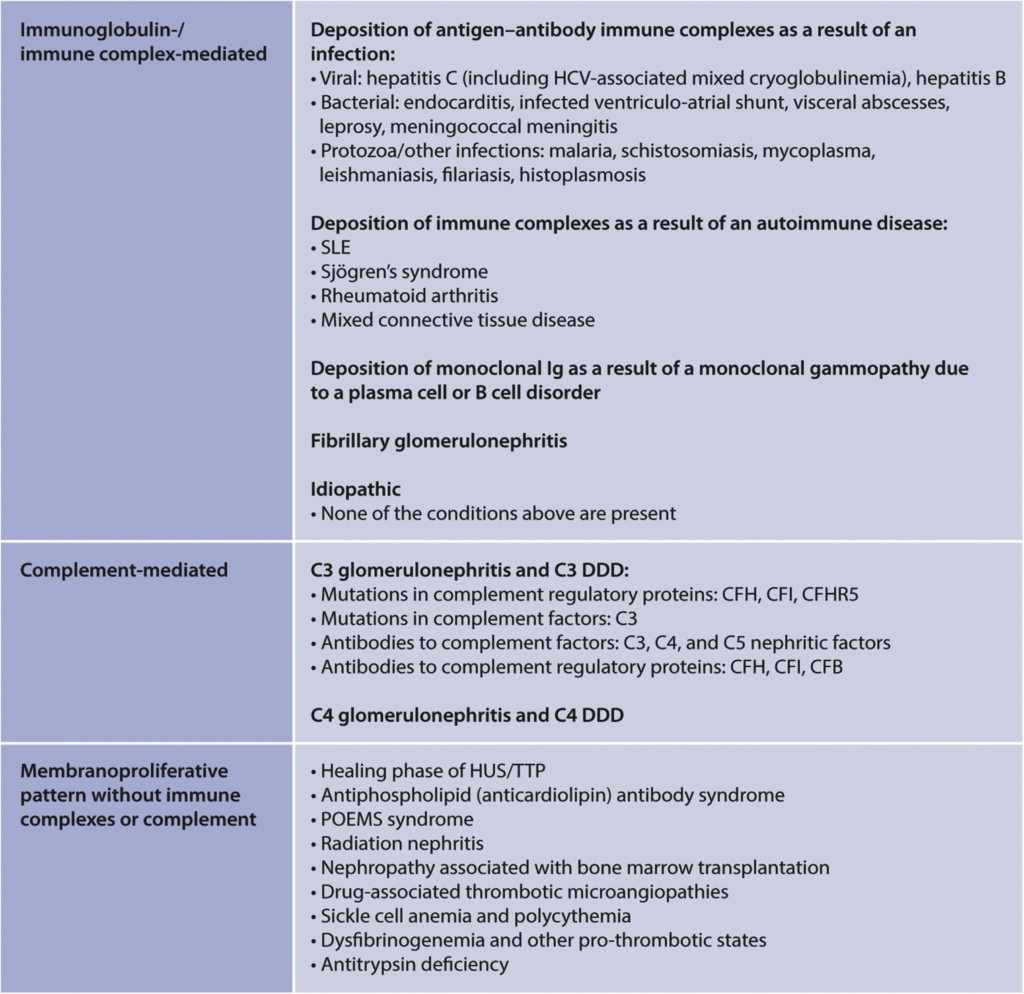
Figure 68 | Causes of a membranoproliferative pattern of injury. CFB, complement factor B; CFH, complement factor H; CFHR5, complement factor H–related protein 5; CFI, complement factor I; DDD, dense deposit disease; HCV, hepatitis C virus; HUS, hemolytic–uremic syndrome; Ig, immunoglobulin; MPGN, membranoproliferative glomerulonephritis; POEMS, polyneuropathy, organomegaly, endocrinopathy, monoclonal protein, skin changes; SLE, systemic lupus erythematosus; TTP, thrombotic thrombocytopenic purpura.
Om patiënten te kunnen behandelen is het zaak het mechanisme achter het beschadigingspatroon bloot te leggen.
De oude classificatie van MPGN gebeurde op basis van de lokalisaties van deposities geïdentificeerd door middel van EM (naast LM):
Deze historische classificatie was niet gebaseerd op het ziektemechanisme, en uiteenlopende ziekteprocessen werden op deze manier samengebracht onder één noemer ‘MPGN’.
Vooruitgang in ons begrip over de onderliggende ziektes en de manier waarop deze tot ‘MPGN’-laesies leiden hebben geresulteerd in een nieuwe ‘pathobiologie’-gebaseerde classificatie. Deze nieuwe classificatie rust op lichtmicroscopische evaluatie; deposities worden gedefinieerd als ofwel immuunglobuline (monoclonaal), danwel polyclonale immuunglobulines samen met complement, en tenslotte solitair complement (figuur 69).
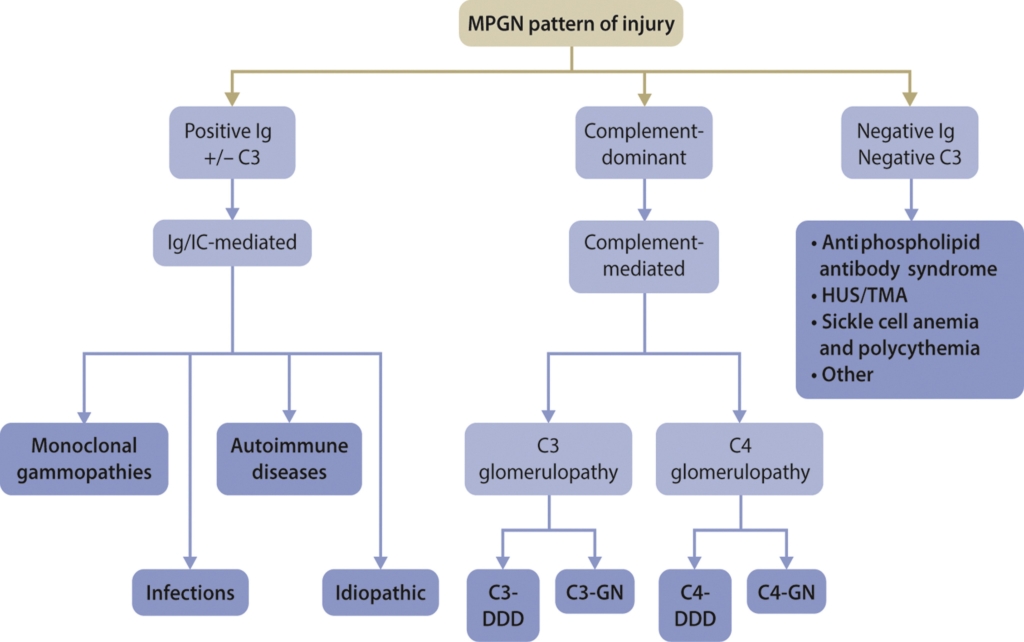
Figure 69 | Pathophysiology of membranoproliferative lesions. DDD, dense deposit disease; GN, glomerulonephritis; HUS, hemolytic– uremic syndrome; IC, immune complex; Ig, immunoglobulin(s); MPGN, membranoproliferative glomerulonephritis; TMA, thrombotic microangiopathy.
Als bij een MPGN immuunglobuline-neerslag betrokken is, moet naar infectieuze oorzaken, auto-immuniteit en M-proteïne gezocht worden, ongeacht of er ook complement-neerslag gezien wordt. Als de complement-depositie predominant is, is een verdere differentiatie mogelijk tussen C3- of C4-nefropathie. In dit geval dient het alternatieve complement-systeem te worden geëvalueerd. Als de deposities slechts sporen van immuunglobulinen of C3 bevatten dient men bedacht te zijn op TMA.
Het is goed te beseffen dat een ziekteproces leidend tot MPGN al langer aanwezig kan zijn, en dat het beschadigingspatroon door de tijd heen kan hebben gevarieerd van mesangio-proliferatief, tot endocapillair proliferatief en crescentisch, en dat er ook gemengde beelden kunnen worden gezien. De interpretatie van het dominante beschadigingspatroon kan dus afhangen van de indicatiestelling en de timing van de biopsie.
ICGN wordt gekarakteriseerd door deposities van polyclonale immuunglobulines (niet-IgA) met complement. Klassiek wordt deze laesie veroorzaakt door chronische antigenemie met of zonder circulerende immuuncomplexen. ICGN kan zich met MPGN presenteren, maar ook met een andere glomerulonefritis.
ICGN is meestal het gevolg van:
Proliferatieve nierbeschadiging kan het gevolg zijn van depositie van monoclonale immuunglobulines in het kader van een monoclonale gammopathie. Slechts zelden wordt dit gezien in het kader van manifeste hematologische ziektes als M. Waldenstrom, multipele myeloom of bij B-cel-lymfomen. Vaker echter gaat het om een indolentere plasmacel- of lymfocytaire aandoening, en valt de MPGN te classificeren binnen het MGRS-spectrum (monoclonal gammopathy of renal significance). De nierschade is dan het gevolg van monoclonale Immuunglobuline-depositie in de nier. Voorbeelden daarvan zijn immunotactoïde glomerulopathie, cryoglobulinemische glomerulonefritis en proliferatieve glomerulonefritis met monoclonale Immuunglobuline deposities (PGNMID). In ongeveer 70% van PGNMID-casus kan overigens geen clonaliteit van circulerend immuunglobuline of (plasma)cel worden aangetoond. Subtypes MGRS worden onderverdeeld in georganiseerd of ongeorganiseerd op basis de ultrastructurele (EM) eigenschappen van de deposities. Een diepere beschouwing van dit ziektebeeld valt buiten de focus van deze KDIGO-guideline.
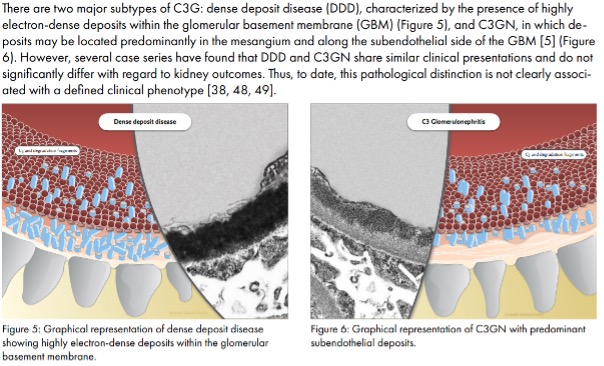
C3G is een zeldzame aandoening die berust op glomerulonefritis met C3-dominantie in de IF (minimaal 2 graden positiever in de IF dan enige andere immuunreactant). Hieronder valt naast C3GN ook DDD. DDD toont zeer electron-dense deposities vooral intramembraneus, C3G laat zowel mesangiaal als capillair deposities zien die in de regel minder intens zijn (figuur 5 en 6 uit [1]). Men dient, zeker bij Ig-aankleuring extra beducht te zijn op monoclonale deposities. Immuunfluorescentie-onderzoek op paraffine met pronase (pronase IF) kan helpen om monoclonaal Ig te demaskeren.
C3G met een MPGN-patroon kan voorkomen, en in die gevallen is hypocomplementemie slechts in ongeveer 50% aanwezig. Aan C3G ligt gestoorde alternatieve-pathway-regulatie ten grondslag.
Glomerulopathiën waarbij niet C3, maar C4d in de immunofluorescentie wordt gezien zijn inmiddels ook beschreven. In hoeverre dit ziektebeeld ook verklaard wordt door gestoorde complement-regulatie is nog niet geheel duidelijk.
NFN praktisch punt 8.1.0: Initieel onderzoek bij patiënten met proteïnurie.
Commentaar:
In een vroeg stadium, al voor een nierbiopsie, is het zinvol om bloedonderzoek te verrichten op het voorkomen van hepatitis B en C, HIV. Tevens zal vaak al zijn gescreend op ANA, ANCA, screening M-proteïne, en op afwijkingen in het complement (C3, C4).
Practice Point 8.1.1: Evaluate patients with immune complex-mediated GN (ICGN) for underlying disease (Figure 68).
Onderbouwing:
Sluit hepatitis B en C uit. Overweeg of er chronische infecties kunnen zijn als endocarditis, of abcessen, schimmels of, bij een geschiedenis van tropenbezoek, schistosomiasis of malaria. Streptococcenserologie dient te geschieden bij patiënten indien hiervoor anamnestisch aanknopingspunten zijn.
Overweeg of er SLE, Sjögren of reumatoïde arthritis kan zijn.
Een onderliggende immuundeficiëntie als HIV of CVID kan ICGN uitlokken.
ICGN kan geassocieerd zijn met maligniteit; een goede screening middels anamnese en lichamelijk onderzoek en leeftijd-geassocieerd bevolkingsonderzoek dient plaats te vinden.
Practice Point 8.1.2: Evaluate patients with GN and monoclonal immunoglobulin deposits for a hematologic malignancy.
Onderbouwing:
Patiënten met proliferatieve glomerulonephritis met monoclonale immuundeposities (PGNMID) behoren ongeacht hun leeftijd een complete evaluatie voor hematologische maligniteit, plasmaceldyscrasie of maligne lymfoom te ondergaan, inclusief
Commentaar:
Als er een onderliggend hematologisch probleem is, vindt behandeling plaats door de hematoloog. Eventueel dient hierbij een regionale of landelijke werkgroep MGRS te worden geconsulteerd.
Practice Point 8.1.3: If no underlying etiology is found for ICGN after extensive workup, evaluate for both complement dysregulation and drivers of complement dysregulation (Figure 70).
Onderbouwing:
Wetenschappelijke gegevens laten zien dat complement-dysregulatie een rol speelt bij ICGN. Bovendien laten cohortdata zien dat klassieke C3G zich kan maskeren als ICGN (dus significant immunoglobuline kan aanwezig zijn) als er een infectieuze prikkel aanwezig is ten tijde van de nierbiopsie. Het aantonen van overvloedige complementactiviteit kan de beslissing ondersteunen te behandelen in plaats van ondersteunende maatregelen toe te passen of standaard immunosuppressie voor actieve glomerulonefritis te starten. Onder een complete work-up van complement wordt het meten van complementactiviteit verstaan, meting van niveaus van complementeiwitten in het serum en in geselecteerde gevallen screening op antilichamen tegen complement-regulatie-eiwitten en genetische studies (figuur 70).

Figure 70 | Evaluation of abnormalities of the alternative pathway of complement. Adapted from Kidney International, volume 89, issue 2, Angioi A, Fervenza FC, Sethi S, et al. Diagnosis of complement alternative pathway disorders, pages 278–288, Copyright ª 2016, with permission from the International Society of Nephrology.539 ‡ The presence of a circulating monoclonal gammopathy is less common below the age of 50 years. Ability to detect a monoclonal protein will depend on the sensitivity of the assay used. † Some complement assays may require referral to specialist/research laboratories, and interpretation of complement assays may require expert consultation. AP50, complement alternate pathway activation 50%; Bb, activated factor B; C3d, complement component 3d; C4d, complement component 4d; CFB, complement factor B; CFH, complement factor H; CFHR1-5, complement factor H–related protein 1-5; CFI, complement factor I; CH50, complement hemolytic activity 50%; FB, factor B; FH, factor H; FI, factor I; Ig, immunoglobulin; IgA, immunoglobulin A; IgG, immunoglobulin G; IgM, immunoglobulin M; MLPA, multiplex ligation-dependent probe amplification; sMAC, soluble membrane attack complex.
Practice Point 8.1.4: Rule out infection-related GN or postinfectious GN prior to assigning the diagnosis of C3 glomerulopathy (C3G).
Onderbouwing:
Zowel infectiegerelateerde GN (dus in aanwezigheid van actieve infectie) als postinfectieuze GN (dus na genezing van een infectie) wordt verondersteld een eenmalig acuut ziekteproces te zijn waarvoor alleen een gelimiteerde work-up nodig is. De behandeling is gericht op de infectie en ondersteuning van de nierfunctie. Immunosuppressie is niet nodig, behoudens in extreme gevallen (bijvoorbeeld snel progressief nierfunctieverlies en/of extracapillaire proliferaties) en altijd pas nadat de infectie onder controle is.
Practice Point 8.1.5: Evaluate for the presence of a monoclonal protein in patients who present for the first time with a C3G diagnosis at ‡50 years of age (Figure 69).
Onderbouwing:
C3G in zijn klassieke vorm is een ziekte van kinderen en jongvolwassenen gerelateerd aan antilichaam (nephritic factor)-gemedieerde dysregulatie van de enzymcomplexen van de alternatieve complementroute of tegen andere cruciale complementroute-eiwitten en in mindere mate aan mutaties in genen die coderen voor factor H, factor I, complement factor H-related (CFHR) eiwitten of C3. Recentelijk is er een associatie beschreven tussen de productie van een monoclonaal eiwit bij ouderen en het ontwikkelen van C3G. Bij patiënten > 50 jaar met C3G varieert de incidentie van monoclonale gammopathie van 31 tot 85% (versus 3% bij controles).
C3G geassocieerd met een monoclonaal eiwit is echter ook beschreven bij patiënten van 20-47 jaar. Deze associatie berust op epidemiologische bevindingen omdat bij de meeste patiënten het direct bewijs ontbreekt dat het monoclonale eiwit de C3G heeft veroorzaakt. Wel lijkt het zo dat sommige monoclonale eiwitten complement-dysregulerende eigenschappen hebben, vooral via directe activatie van de alternatieve route.
Het belang van het vinden van een monoclonale B-celziekte volgt uit de gelimiteerde data die suggereren dat een therapeutische strategie om de kloon te behandelen een paraproteïne geassocieerde C3G verbetert. (Een uitvoerige uiteenzetting over de evaluatie van verdenking monoclonaal eiwit valt buiten de scope van dit document).
Algemeen commentaar Nederlandse situatie:
Algemeen:
Eerdere richtlijnen ondersteunden het gebruik van oraal cyclofosfamide of MMF plus glucocorticoïden in een lage dosis als een therapeutische benadering van ICGN, vooral bij mensen met idiopathische ziekte en nefrotisch syndroom en/of snel progressieve ziekte. De vooruitgang in ons begrip van onderliggende ziekte mechanismen die een verandering in de nomenclatuur hebben veroorzaakt, hebben ook de heterogeniteit van eerdere cohorten benadrukt. Bovendien is idiopathische ICGN een zeer zeldzame aandoening bij volwassenen. Er is noodzaak tot een meer geïndividualiseerde aanpak. De optimale behandeling van veel van de aandoeningen die een MPGN-schadepatroon geven moet nog worden gedefinieerd. Tenzij anders aangegeven, zijn de onderstaande praktijk punten gebaseerd op bewijs van zeer lage kwaliteit, klinische ervaring en expert mening. De behandeling wordt vaak beïnvloed en bepaald door de ernst van proteïnurie en nierfunctiestoornis.
Practice Point 8.2.1.1: When the cause of ICGN is determined, the initial approach to treatment should focus on the underlying pathologic process.
Onderbouwing:
De meest effectieve behandeling in deze situatie is gericht op het onderliggende pathofysiologische proces. Hiernaast is het waarschijnlijk dat patiënten met actieve glomerulaire ziekte baat hebben bij de routine-zorg zoals beschreven in “NFN glomerulonefritis hoofdstuk 1: algemene principes van behandeling” NFN glomerulonefritis hoofdstuk 1: algemene principes behandeling – MEDonline publisher (nefro.nl)
Commentaar:
Met name bij hematologische betrokkenheid in de etiologie van ICGN verdient het de aanbeveling om patiënten te verwijzen naar een gespecialiseerd centrum teneinde de optimale behandelstrategie te bepalen. Bij een infectieuze oorzaak (b.v. hepatitis, endocarditis, etc.) met passend beloop (éénmalig acuut ziekteproces) en geen verdenking op een bijkomende complement stoornis is tertiaire verwijzing in principe niet geïndiceerd.
Practice Point 8.2.1.2: Indolent ICGN, whether idiopathic or linked to a primary disease process, is best managed with supportive care and carefully considered use of immunosuppression.
Onderbouwing:
Na afname van actieve inflammatie kan er sprake zijn van een indolent beloop met als klinische uiting een niet actief sediment en variabele mate van proteïnurie en kreatinine stijging. Tenzij het nier biopt actieve inflammatie laat zien dienen patiënten met dit beloop in principe alleen met RAAS blokkade behandeld te worden. Patiënten die zich presenteren met gevorderde schade en grote mate van interstitiële fibrose en tubulus atrofie in het biopt hebben een beperktere kans op respons op immunosuppressie, ongeacht aanwezigheid van actieve inflammatie in het biopt. Dit is van belang om mee te nemen in de overweging om wel of niet immunosuppressief te behandelen.
Practice Point 8.2.1.3: For patients with idiopathic ICGN and proteinuria <3.5 g/d, the absence of the nephrotic syndrome, and a normal eGFR, we suggest supportive therapy with RAS inhibition alone.
Onderbouwing:
Er is geen ondersteunend bewijs voor behandeling met immunosuppressie bij volwassen. Gezien het mogelijke risico op ziekteprogressie is regelmatige controle van serum kreatinine, proteïnurie en sediment geadviseerd. Ook voor kinderen zonder nefrotisch syndroom zijn er geen data die richting geeft aan grenswaarden voor starten met immunosuppressieve behandeling. In de richtlijn wordt de erkenning uitgesproken dat in de praktijk bij minder proteïnurie overgegaan wordt tot immunosuppressieve therapie en dat meest waarschijnlijk mycofenolaat mofetil wordt gebruikt als glucocorticoïd sparende optie.
Commentaar:
Wat betreft de Nederlandse situatie herkent de werkgroep dat ook bij proteïnurie van minder dan 3.5 gr/dag immunosuppressieve behandeling wordt voorgeschreven. De neiging tot starten van immunosuppressie zal afhangen van de respons op adequate RAAS inhibitie/zoutbeperking en het beloop. Over het algemeen zal bij een proteïnurie van >1,5 – < 3.5gr/dag niet zelden toch overwogen worden immunosuppressieve therapie te starten. Hiertoe dient een individuele risicoafweging gemaakt te worden op basis van patiënt en ziektekenmerken.
Er is geen bewijs voor SGLT2 remmers in deze specifieke situatie maar in het kader van algemene nefrologische principes kan dit overwogen worden.
Practice Point 8.2.1.4: For patients with idiopathic ICGN, a nephrotic syndrome, and normal or near-normal SCr, try a limited treatment course of glucocorticoids.
Onderbouwing:
De KDIGO richtlijn adviseert een behandeling met een prednison dosering van 1 mg/kg (max. van 60-80 mg/dag) gedurende 12-16 weken met nadien tapering over 6-8 maanden indien klinische respons. Indien er <30% reductie is van proteïnurie na 12-16 weken dan is het advies prednison af te bouwen tot stop. Een langdurige behandeling met prednison wordt niet geadviseerd en de optie van een prednison sparende behandeling dient te worden overwogen.
Commentaar:
Ook in de Nederlandse situatie is prednison een belangrijke pijler van de behandeling en wordt toevoeging van bv. mycofenolaat mofetil gesuggereerd als proliferatieremmer en prednison-sparend middel waarbij er geen eenduidige behandelduur en afbouwschema is te geven. De in de KDIGO-richtlijn genoemde dosering en behandelduur van prednison is naar de mening van richtlijnencommissie erg hoog. Een alternatief is een startdosis van 1 mg/kg met een snelle tapering zoals vaak wordt gebruikt bij de behandeling van systeemziekten [2].
De KDIGO richtlijn geeft aan dat een CNI is te overwegen indien er een contra-indicatie is voor prednison op basis van beperkte data en naar analogie van andere nefrotische ziekten. De richtlijncommissie is onzeker over de plaats van CNI in deze specifieke situatie.
Over de potentiële rol van rituximab in de behandeling kan geen gefundeerd advies gegeven worden.
Practice Point 8.2.1.5: For patients with idiopathic ICGN, abnormal kidney function (but without crescentic involvements), active urine sediment, with or without nephrotic-range proteinuria, add glucocorticoids and immunosuppressive therapy to supportive care.
Onderbouwing:
De richtlijn beschrijft een getrapte behandeling op basis van ziektebeloop met prednison monotherapie, prednison met mycofenolaat mofetil en uiteindelijk, na herhaalde nierbiopsie, prednison met rituximab of cyclofosfamide. Deze strategie is in grote lijnen vergelijkbaar met de Nederlandse situatie waarbij prednison in combinatie met mycofenolaat mofetil eerder in het ziektebeloop wordt gegeven en langdurig monotherapie prednison in principe niet de voorkeur heeft.
De KDIGO-richtlijn geeft geen handvat voor afbouw van immunosuppressie bij het bereiken van remissie. Wel is er een advies bij patiënten met aanhoudende ziekteactiviteit ondanks ten minste 6 maanden MMF plus lage dosis prednison of na 3-6 maanden dagelijks oraal cyclofosfamide of rituximab plus prednison, te stoppen met immunosuppressie en door te gaan met ondersteunende therapie.
Commentaar:
Wij concluderen ook hier dat behandeling na zorgvuldige afweging op basis van ziekte en patiënt karakteristieken moet plaatsvinden in een gespecialiseerd centrum. Hierbij moet ruimte zijn voor lokale ervaringen (bijvoorbeeld met betrekking tot keuze tussen cyclofosfamide of rituximab).
Practice Point 8.2.1.6: For patients presenting with a rapidly progressive crescentic idiopathic ICGN, treat with high-dose glucocorticoids and cyclophosphamide.
Onderbouwing:
Start behandeling met intraveneus methylprednisolon gevolgd door oraal glucocorticoïden en oraal cyclofosfamide in een regime vergelijkbaar met de behandeling van ANCA-vasculitis. (conform NFN richtlijn ANCA vasculitis, die binnenkort beschikbaar is)
Practice Point 8.2.1.7: For most patients with idiopathic ICGN presenting with an eGFR <30 ml/min per 1.73 m2 , treat with supportive care alone.
Onderbouwing:
Tenzij nierbiopsie een actieve necrotiserende crescentische glomerulonefritis of een andere reden die het gebruik van immunosuppressie ondersteunt (d.w.z. minimaal interstitieel fibrose of gelijktijdige acute tubulo-interstitiële nefritis) laat zien, moet voor deze patiënten met terughoudendheid worden gekozen voor immunosuppressie. Uiteraard ook aandacht voor een eventuele discrepantie tussen eGFR en werkelijke klaring tgv lichaam compositie. Tijdige verwijzing voor evaluatie voor niertransplantatie is geïndiceerd.
Practice Point 8.2.1.8: Patients who fail to respond to the treatment approaches discussed in 8.2.1.4 and 8.2.1.5 should be considered for a clinical trial where available.
Commentaar:
Voor een actueel overzicht van beschikbare trials zie nefro.nl.
Algemeen:
Een optimale behandelingsstrategie voor C3G met behulp van de momenteel beschikbare therapeutische middelen is niet vastgesteld. Deskundigenoordeel adviseert de gebruikelijke ondersteunende maatregelen (NFN glomerulonefritis hoofdstuk 1: algemene principes behandeling – MEDonline publisher (nefro.nl).
en het gebruik van immunosuppressie in het geval van matige – ernstige ziekte, gedefinieerd als matige tot duidelijke proliferatie in het nierbiopt en proteïnurie (>1 g/d, figuur 8 uit [1]). Deze mening is voornamelijk gebaseerd op 4 retrospectieve cohorten en op een extrapolatie van gegevens van andere niet-gerelateerde proliferatieve glomerulonefritiden. Goed gecontroleerde gegevens zijn niet beschikbaar.
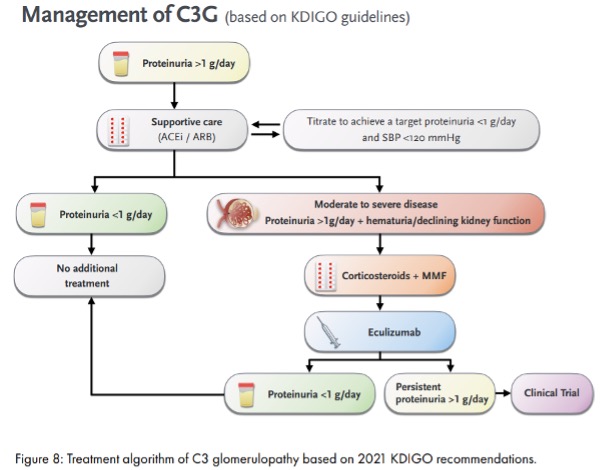
Practice Point 8.2.2.1: In the absence of a monoclonal gammopathy, C3G in patients with moderate-to-severe disease should be treated initially with MMF plus glucocorticoids, and if this fails, eculizumab should be considered.
Aanvullend NFN practice point:
Gezien zeldzaamheid van deze ziekte en mogelijke introductie van nieuwe, effectieve remmers van de alternatieve complement pathway adviseert de NFN om behandeling van C3G in (samenspraak met) een gespecialiseerd centrum te doen. Eculizumab kent geen duidelijke plaats voor volwassenen in de Nederlandse situatie en wordt op dit moment niet vergoed vanuit het basispakket. In Nederland dienen patiënten verwezen te worden voor evaluatie studiedeelname indien mogelijk en beschikbaar (zie 8.2.2.2).
Onderbouwing:
Overweeg immunosuppressieve behandeling van patiënten met C3G met >1gr/dag proteïnurie en hematurie of een achteruitgaande nierfunctie gedurende minimaal 6 maanden. Immunosuppressieve behandeling is niet in gerandomiseerde prospectieve studies onderzocht. De gerapporteerde effectiviteit van immunosuppressieve behandeling in C3G is variabel. De combinatie van glucocorticoïden en MMF lijkt in een aantal retrospectieve observationele studies het meest effectief.
De voordelen van terminale complementblokkade met het anti- C5 monoklonaal antilichaam eculizumab zijn niet vastgesteld. Bij gebrek aan duidelijk bewijs kan het gebruik van eculizumab worden overwogen bij patiënten met progressieve ziekte die niet reageren op andere therapieën. Echter in Nederland heeft Eculuzimab geen plaats in de behandeling bij volwassenen en verwijzen we naar 8.2.2.2.
Practice Point 8.2.2.2: Patients who fail to respond to the treatment approaches discussed in 8.2.2.1 should be considered for a clinical trial where available.
Commentaar:
De behandeling van patiënten met C3G (C3GN dan wel DDD) dient laagdrempelig te geschieden in een gespecialiseerd centrum of in nauwe samenwerking met een gespecialiseerd centrum. Voor een actueel overzicht van beschikbare trials zie nefro.nl.
[1] KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int, 2021. 100(4S): S1-S276.
[2] Caracava-Fontan F, Goicoechea de Jorge E, Praga M. Neph-Manual Membranoproliferative Glomerulonephritis and complement-mediated Kidney diseases. 2023.
© 2022. Alle rechten voorbehouden