Leidraad SGLT2-remmers bij patiënten met chronische nierschade zonder diabetes mellitus type 2
Autorisatiedatum: 30-05-2023
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
Deze leidraad bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de leidraad in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van een goede zorg voor de patiënt, van deze adviezen moet worden afgeweken.
Dr. M.A. van Leeuwen, internist-nefroloog
Dr. H.W. van Hamersvelt, internist-nefroloog
Dr. L. Jakulj, internist-nefroloog Amsterdam UMC en Dianet Amsterdam
Namens Nederlandse Federatie voor Nefrologie richtlijnencommissie verantwoordelijk
Dr. L. Jakulj, internist-nefroloog Amsterdam UMC en Dianet Amsterdam
Geen belangenverstrengeling
SGLT2-remmers bij patiënten met type 2 diabetes en CNS
Recent zijn twee richtlijnen verschenen waarin sodium-glucose co-transporter (SGLT2)-remmers een prominente plaats hebben gekregen in de behandeling van patiënten met type 2 diabetes mellitus (DM2) en chronische nierschade (CNS). Dit betreft de multidisciplinaire richtlijn ‘Farmacotherapie bij zeer hoog-risico patiënten met diabetes mellitus type 2 (DM2)’ 20211en de KDIGO richtlijn ‘Diabetes Management in CKD’ 20222. In de multidisciplinaire richtlijn ‘Farmacotherapie bij zeer hoog-risico patiënten met diabetes mellitus type 2 (DM2)’ 2021 wordt de volgende aanbeveling gedaan:
‘Overweeg het gebruik van een SGLT2-remmer als monotherapie of toegevoegd aan metformine en/of elke andere combinatie van glucoseverlagende therapie (inclusief insulinetherapie) bij volwassenen met DM type 2 indien er sprake is van een zeer hoog risico op hart- en vaatziekten:
eerder bewezen hart- en vaatziekten en/of
chronische nierschade met: eGFR 30-44 ml/min/1,73 m2 zonder of met verhoogde albuminurie; eGFR 45-59 ml/min/1,73 m2 met matig verhoogde albuminurie (ACR > 3 mg/mmol/l) of eGFR ≥ 60 ml/min/1,73 m2 met ernstig verhoogde albuminurie (ACR > 30 mg/mmol)
De rationale achter deze aanbeveling is niet de mate van glucoseverlaging door deze middelen, maar de door SGLT2-remming bereikte afname van cardiovasculaire ziekten en bijbehorende ziektelast (hartfalen in het bijzonder), evenals vertraging van de progressie van nierschade en bijbehorende ziektelast (en daarmee dus ook de noodzaak tot behandeling met dialyse of niertransplantatie).
Voor adviezen en aanbevelingen t.a.v. het gebruik van SGLT2-remmers bij patiënten met DM2 en CNS verwijzen wij naar bovenstaande richtlijn(en). Hierbij moet worden vermeld dat er in de multidisciplinaire richtlijn geen uitspraken worden gedaan over patiënten met DM2 na niertransplantatie. De KDIGO richtlijn uit 2022 stelt dat SGLT2-remmers nog onvoldoende onderzocht zijn bij patiënten na niertransplantatie, die mogelijk baat kunnen hebben bij SGLT2-remming, maar mogelijk ook een verhoogd risico op infecties kunnen hebben ten gevolge van deze behandeling. Daarom gelden de aanbevelingen in de KDIGO richtlijn (nog) niet voor patiënten na niertransplantatie (Practice Point 1.3.7)2.
SGLT2-remmers bij patiënten met hartfalen
De SGLT2-remmers dapagliflozine en empagliflozine zijn geregistreerd voor de behandeling van hartfalen met verminderde (‘reduced’) ejectiefractie (HFrEF) en hartfalen met matig verminderde (‘midrange’) ejectiefractie (HFmrEF). Inmiddels zijn er ook studies die cardiovasculaire (en renale) bescherming door SGLT2-remmers tonen bij patiënten met hartfalen met behouden (‘preserved’) ejectiefractie (HFpEF)3-5. Deelnemers aan deze ‘hartfalen-studies’ hadden allen een vorm van hartfalen en deel van hen had ook CNS of DM2 of allebei. Aangezien deze aandoeningen vaak simultaan voorkomen bij patiënten met CNS, zijn de cardio-renale uitkomsten uit deze studies ook relevant voor de dagelijkse nefrologische praktijk en zijn, waar van toepassing, ook meegenomen in de overwegingen en adviezen in dit document.
SGLT2-remmers bij patiënten met CNS zonder DM2
Er zijn op dit moment geen (inter)nationale richtlijnen beschikbaar over de inzet van SGLT2-remmers ten behoeve van cardio-renale bescherming bij patiënten met CNS zonder DM2 of hartfalen als indicatie voor de SGLT2-remmer. Er is wel een landelijke richtlijn uit het Verenigd Koninkrijk met adviezen t.a.v. de inzet van SGLT2-remmers bij patiënten met CNS zonder DM2.6
De NfN-richtlijnencommissie acht op basis van de huidige literatuur dat SGLT2-remmers van meerwaarde kunnen zijn bij de behandeling van patiënten in deze groep. Deze literatuur beperkt zich met betrekking tot deze categorie patiënten vooralsnog tot de deelnemers zonder DM2 van de: DAPA-CKD studie7, de zeer recent gepubliceerde EMPA-KIDNEY trial8 en subgroepen van de eerder genoemde ‘ hartfalen-studies’. Zeer onlangs is er meta-analyse verschenen met gepoolde data van de circa 16,000 deelnemers zonder DM2 uit bovenstaande studies9, die de inzet van SGLT2-remming ten behoeve van cardiovasculaire en renale bescherming bij patiënten met CNS zonder DM2 verder ondersteunt.
De NfN-richtlijnencommissie zal in bovenstaand kader binnenkort starten met een concept- herziening van de multidisciplinaire FMS richtlijn chronische nierschade (NfN, NIV, NHG 2018) teneinde een evidence-based advies te kunnen geven met betrekking tot de indicatie voor de behandeling met SGLT2-remmers van patiënten met CNS zonder DM2. Hierin zal ook worden benoemd bij welke patiënten met CNS SGLT2-remming duidelijke meerwaarde heeft en in welke situaties SGLT2-remmers bij voorkeur niet gebruikt dienen te worden. Daarnaast zal deze herziening zich ook richten op de plaatsbepaling van SGLT2-remmers ten opzichte van andere (nieuwe) middelen gericht op cardio-renale bescherming.
Per 1 mei 2022 is de SGLT2-remmer dapagliflozine door Zorginstituut Nederland goedgekeurd voor de behandeling van cardiovasculaire en renale risicofactoren bij patiënten met chronische nierschade. Op dit moment is dapagliflozine de enige SGLT2-remmer die voor deze indicatie (middels een artsenverklaring) wordt vergoed in Nederland. De huidige criteria voor vergoeding luiden: ‘een verzekerde van 18 jaar of ouder met chronische nierschade’ (CNS stadia G1A1 en G2A1 worden niet tot CNS gerekend). Deze ontwikkeling heeft bij zowel professionals als patiënten de behoefte aan adviezen en handvatten ten aanzien van de inzet van SGLT2-remmers bij patiënten met CNS gevoed.
Derhalve heeft de NFN-richtlijnencommissie in afwachting van de herziening van de multidisciplinaire richtlijn chronische nierschade (module ‘medicamenteuze behandeling cardiovasculaire en renale risicofactoren bij patiënten met CNS’) de huidige leidraad opgesteld. Dit is een dynamisch document in afwachting van de uitkomsten van aanvullende studies en (inter)nationale multidisciplinaire richtlijnen met betrekking tot het gebruik van SGLT2-remmers bij de behandeling van patiënten met chronische nierschade zonder DM2 of hartfalen.
Practice Points
Informeer de patiënt bij start van de SGLT2-remmer dat de eGFR hoogstwaarschijnlijk zal dalen, hetgeen een farmacodynamisch effect en in principe geen verslechtering van de nierfunctie betreft.
Overweeg aanpassing van vochtintake en/of de dosis van antihypertensiva/diuretica indien de patiënt hypotensie of andere tekenen van volumedepletie ontwikkelt na start van de SGLT2-remmer.
Bespreek de risico’s van dehydratie ten tijde van behandeling met een SGLT2-remmer en de noodzaak om bij (dreigende) dehydratie contact op te nemen met de behandelend arts. Dit geldt met name bij patiënten met een verhoogd risico op dehydratie, zoals bij diureticagebruik en/of bij ouderen. Overweeg de behandeling met SGLT2-remmers tijdelijk te staken als er sprake is van (dreigende) dehydratie.
Licht de patiënt in over het mogelijk optreden en herkennen van:
Genitale bijwerkingen (met name mycotische infecties). Een mycotische infectie is geen reden om de SGLT2-remmer direct te staken en is over het algemeen goed te behandelen met een (in eerste instantie topicaal) anti-mycotisch middel. Heroverweeg voortzetting van de SGLT2-remmer bij frequente recidieven of ernstige mycotische infecties.
Ketoacidose. Vanwege de ernst van deze aandoening, ondanks de zeer lage incidentie (0.01%) bij patiënten zonder DM. Gebruik geen SGLT2-remmers indien er (tijdelijk) een verhoogd risico is op ketoacidose, zoals bij alcoholisme, ondervoeding, intermitterend vasten of een dieet met < 70 gram koolhydraten per dag. Informeer de patiënt over de noodzaak om inname van de SGLT2-remmer (tijdelijk) te staken bij elke situatie waarin de voedselinname fors verminderd is, bij koortsende ziekte, misselijkheid, braken, extreme dorst, diarree en bij een chirurgische ingreep, en om in deze gevallen contact op te nemen met de behandelend arts. Ketoacidose dient te worden overwogen bij mogelijke volume-depletie in combinatie met een metabole acidose na start van een SGLT2-remmer.
* De aanbevelingen zijn vooralsnog alleen gebaseerd op studies met dapagliflozine en empagliflozine. In Nederland bestaat alleen vergoeding voor dapagliflozine voor deze indicatie (middels een artsenverklaring).
Figuur 1. Advies inzet SGLT2-remmers bij patiënten met CNS naast maximale RAAS-inhibitie
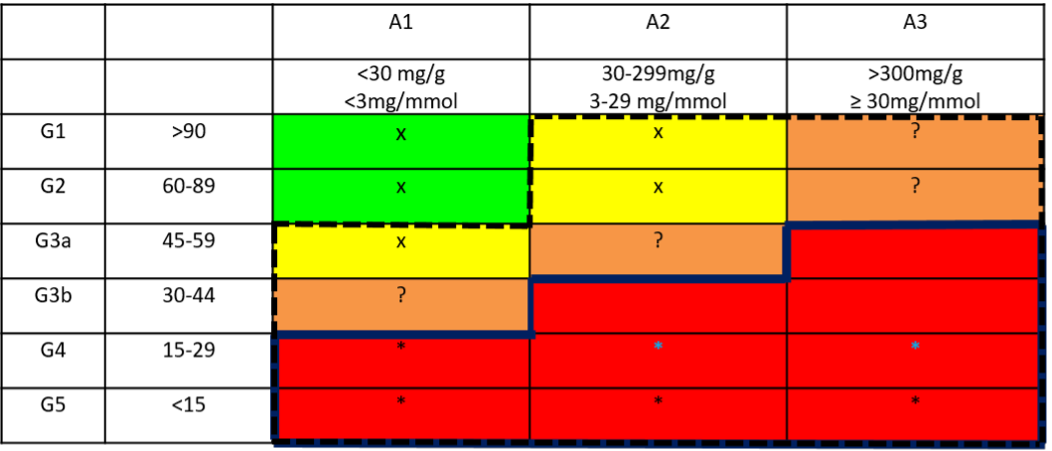
Kader met doorgetrokken lijn: start SGLT2-remmer bij deze CNS stadia naast maximaal verdragen RAAS-inhibitie (mits niet gecontra-indiceerd), ten behoeve van cardio-renale bescherming op basis van huidige literatuur (studies met dapagliflozine en empagliflozine).
Kader met onderbroken lijn: bij deze CNS stadia wordt dapagliflozine vergoed in Nederland (middels artsenverklaring).
x: geen indicatie noch vergoeding SGLT2-remmer (groene stadia) ; geen indicatie wegens ontbrekende gegevens (gele stadia)
? cardio-renale voordeel van toepassing SGLT2-remmers nog onduidelijk, vanwege onvoldoende beschikbare gegevens over deze subgroepen in de huidige literatuur bij patiënten met CNS zonder DM2 en mogelijkheid van verminderde effectiviteit van SGLT2-remmers bij patiënten met minder uitgesproken proteïnurie. Start van een SGLT2-remmer bij deze categorie patiënten kan overwogen worden bij stadium A3 proteïnurie ondanks maximaal verdragen RAAS blokkade en/of patiënten met een relatief snelle nierfunctieachteruitgang (zie ‘Literatuur en onderbouwing leidraad SGLT2- remmers bij patiënten met CNS zonder DM2’ in de bijlage).
* bij eGFR <20 ml/min/1.73 m2 geen SGLT2-remmer starten, wel continueren tot aan start nierfunctievervangende therapie
Inzet SGLT2-remming bij verschillende CNS stadia
Op basis van de huidige literatuur met betrekking tot het cardiovasculaire en renale voordeel van SGLT2-remmers bij patiënten met CNS zonder DM2 acht de werkgroep de veiligheid en effectiviteit van de inzet van dapagliflozine of empagliflozine, naast maximaal tolereerbare RAAS-inhibitie, voldoende bewezen voor patiënten met een zeer hoog KDIGO risico (rode groepen in Figuur 1). Voor toepassing van SGLT2-remmers bij de CNS stadia buiten het doorgetrokken kader van Figuur 1 bestaat op basis van de huidige literatuur nog onvoldoende wetenschappelijke onderbouwing. Zie hiertoe, en voor de verdere verantwoording van de adviezen en overwegingen, de bijlage: ‘Literatuur en onderbouwing leidraad SGLT2-remmers bij patiënten met CNS zonder DM2’. Vooralsnog wordt in Nederland alleen dapagliflozine voor deze indicatie vergoed, zij het voor een ruimere categorie patiënten met CNS (kader met onderbroken lijn in figuur 1).
De werkgroep adviseert te starten met een SGLT2-remmer bij een eGFR ≥20 ml/min/1.73m2. Dit wijkt af van het huidige advies voor patiënten met DM2 in de multidisciplinaire richtlijn ‘Medicamenteuze behandeling zeer hoog-risico patiënten met DM2’ en van het SPMC van dapagliflozine, alsook het farmacotherapeutisch kompas (‘starten van de behandeling bij een eGFR <25 ml/min/1.73m2 wordt ontraden, wegens beperkte ervaring’).
De grens van eGFR<25 ml/min/1.73m2 is gebaseerd op de inclusiecriteria van de DAPA-CKD studie en geldt ook voor de indicatie hartfalen, gebaseerd op de inclusiecriteria van de DAPA-HF studie. De werkgroep adviseert start van dapagliflozine en empagliflozine bij een eGFR van 20 ml/min/1.73m2, gebaseerd op onder andere de recente resultaten van de EMPA-KIDNEY studie, waarin behandeling met empagliflozine cardio-renale winst bood ten opzichte van placebo bij 5,210 deelnemers met een eGFR 20-45 ml/min/1.73m2 (waarvan 46% zonder DM2). Deze winst was er ook bij de subgroep van 2,462 deelnemers met een eGFR 20-30 ml/min/1.73m2. Of behandeling met SGLT2-remmers voordeel biedt aan patiënten met eindstadium nierfalen zal uit aanvullende studies moeten blijken, waaronder de internationale multicenter Renal Lifecycle Trial (NCT05374291). Vooralsnog wordt geadviseerd de behandeling met SGLT2-remmers te staken bij start van nierfunctievervangende therapie. (Zie eventueel ook: Hoofdstuk ‘kennishiaten’ in de bijlage ‘Literatuur en onderbouwing leidraad SGLT2-remmers bij patiënten met CNS zonder DM2’).
De wetenschappelijke onderbouwing van het huidige advies SGLT2-remming toe te voegen aan maximaal tolereerbare RAAS-inhibitie bij patiënten zonder DM2 is het sterkst voor de CNS stadia met een zeer hoog KDIGO-risico op CV-events en eindstadium nierfalen (de rood gemarkeerde stadia binnen het doorgetrokken kader in Figuur 1). Voor de CNS stadia met een hoog KDIGO-risico (oranje groepen in Figuur 1) bestaat minder sterke onderbouwing, omdat patiënten uit deze groepen zonder DM2 niet of minder goed vertegenwoordigd waren in de DAPA-CKD en EMPA-KIDNEY studies. Daarnaast was de (cardio)-renale bescherming door SGLT2-remmers afwezig of minder uitgesproken bij de patiënten in deze KDIGO risicocategorieën en ook bij degenen met minder ernstige proteïnurie (stadia A1 en A2). Derhalve zijn er op dit moment onvoldoende aanwijzingen voor cardio-renaal voordeel van SGLT2-remmers bij patiënten in de oranje groepen in Figuur 1, waardoor behandeling met SGLT2-remmers op dit moment niet aanbevolen kan worden voor deze patiënten met CNS. Op basis van de huidige data acht de werkgroep een mogelijk cardio-renaal voordeel van SGLT2- remmers bij deze categorie patiënten het meest aannemelijk bij degenen met stadium A3 proteïnurie ondanks maximaal tolereerbare RAAS-inhibitie en/of patiënten die een relatief snelle progressie van CNS hebben laten zien, ofschoon er op grond van de huidige data geen goed onderbouwd advies voor de mate van eGFR daling te formuleren is. Voor patiënten met CNS en een matig verhoogd KDIGO-risico (gele groepen uit Figuur 1) bestaat op dit moment geen bewijs voor meerwaarde van behandeling met een SGLT2-remmer.
Onderliggende nierziekte
Zowel in de DAPA-CKD studie als de EMPA-KIDNEY trial werden patiënten met type 1 diabetes mellitus en polycysteuze nierziekten uitgesloten van deelname. Dit geldt ook voor patiënten die een niertransplantatie hadden ondergaan en patiënten die bij randomisatie in de drie (EMPA-KIDNEY) of zes maanden ervoor (DAPA-CKD) behandeld werden met immuunsuppressie. Er zijn dus geen beschikbare gegevens over de effectiviteit (en veiligheid) van SGLT2-remmers bij deze categorieën patiënten. In de DAPA-CKD en EMPA-KIDNEY studies waren de effectiviteit en veiligheid van SGLT2- remmers ten opzichte van placebo vergelijkbaar in de groepen patiënten met diverse andere onderliggende nierziekten.
Acute eGFR daling na start SGLT2-remmer
SGLT2-remmers induceren geregeld een acute daling van de eGFR van gemiddeld 3–8 ml/min per 1.73 m2 twee tot vier weken na start van de behandeling. Deze acute eGFR-daling betreft een farmacodynamisch effect en is reversibel na het staken van de SGLT2-remmer, ook na langdurige behandeling. Daarbij wordt er op de langere termijn juist een tragere achteruitgang van de eGFR ten tijde van behandeling met SGLT2-remmers in vergelijking met placebo waargenomen (Practice point 1). In sommige studies was een acute eGFR-daling ≥10% na start van de SGLT2-remmer geassocieerd met betere cardio-renale uitkomsten. Een acute eGFR-daling van >30%, die ook als grens bij introductie van ACE-remmers of ARBs wordt gehanteerd, kwam veel minder vaak voor in de studies met SGLT2-remmers bij patiënten met en zonder DM2. Gezien de kleine aantallen en verschillen in uitkomsten in methodiek van post-hoc analyses, is over de associatie tussen een acute eGFR-daling >30% en uitkomsten nog onvoldoende bekend. De werkgroep is derhalve van mening dat er onvoldoende grond is om een standaard meting van de nierfunctie 2-4 weken na start van een SGLT2-remmer te adviseren bij alle patiënten zonder DM2 en dat een eGFR daling van > 30% geen reden is om de behandeling met SGLT2-remmers zonder meer te staken. Wel lijkt het raadzaam om bij patiënten met een verhoogd risico op volume-depletie, zoals bijvoorbeeld ouderen en/of patiënten die (hogere doses) diuretica gebruiken, alert te zijn op volumedepletie (en acute nierschade) na start van de SGLT2-remmer en eventuele bijdragende factoren hiertoe te corrigeren (zie Practice points 2 en 3).
Adverse events
Hypotensie en volumedepletie
Het optreden van hypotensie of volumedepletie werd gemeld bij 1-10% van de deelnemers aan de studies met SGLT2-remmers7-9,11,24-26.
Hoewel de beschreven bloeddrukdalingen niet heel uitgesproken zijn, is voorzichtigheid geboden bij patiënten bij wie een door SGLT2-remmers geïnduceerde bloeddrukdaling of volumedepletie mogelijk risicovol is, zoals ouderen en patiënten die naast de RAAS blokkade behandeld worden met meerdere antihypertensiva of diuretica. Gezien het aangetoonde cardio-renale voordeel van SGLT2- remmers in combinatie met RAAS-inhibitie bij patiënten met CNS met een zeer hoog KDIGO-risico, is het sterk te overwegen de behandeling met de SGLT2-remmer in combinatie met RAAS-inhibitie te continueren en in geval van hypotensie en/of volumedepletie, de dosis van andere antihypertensiva en/of diuretica aan te passen. Dit laatste eventueel in overleg met de behandelend cardioloog, indien deze middelen vanwege een cardiale indicatie zijn voorgeschreven (Practice Point 2 en 3).
Hypoglykemie
Uit de publicaties van studies met SGLT2-remmers waaraan ook patiënten zonder DM2 hebben deelgenomen, kan niet altijd goed worden achterhaald of de incidentie van hypoglykemie echt nihil was bij patiënten zonder DM2, maar deze kans is op basis van de huidige literatuur wel zeer klein. Zo werd ernstige hypoglykemie in de DECLARE, DAPA-HF en DAPA-CKD studies alleen bij de deelnemers met DM2 gezien.
De recent gepubliceerde meta-analyse met gepoolde data van RCTs met SGLT2-remmers en placebo bij patiënten met en zonder DM29 toonde met betrekking tot het optreden van hypoglykemie zelfs een klein verschil in het voordeel SGLT2-remming (RR 0.89 (95% CI 0.80;0.98). Hierbij waren de data niet gesplitst voor de subgroepen met en zonder DM2.
Ketoacidose
Ketoacidose ten gevolge van het gebruik van een SGLT2-remmer komt nagenoeg niet voor bij patiënten zonder DM2. In de eerder beschreven meta-analyse9 betrof dit in de populatie zonder DM2: 1 event bij 7,788 deelnemers (0.01%) die met SGLT2-remming behandeld werden, ten opzichte van 0 events bij 7,807 deelnemers die met placebo behandeld werden.
Hoewel het een zeer zeldzame bijwerking is, is de werkgroep van mening dat gezien de ernst van de aandoening en de atypische presentatie (met normale of slechts matig verhoogde serum glucosewaarden) het zeer kleine risico op ketoacidose en de risicofactoren en symptomen van ketoacidose met de patiënt besproken moeten worden (Practice Point 4b).
Een verhoogd risico op ketoacidose kan bestaan bij een (latente) lage bèta-celfunctiereserve, bijvoorbeeld DM2 met een lage C-peptide, auto-immuun diabetes bij volwassenen (LADA) en een voorgeschiedenis van pancreatitis, bij een beperkte voedselinname of ernstige uitdroging, eventueel in combinatie met een hogere insulinebehoefte vanwege acute medische ziekte, operatie of bij alcoholmisbruik. SGLT2-remmers dienen derhalve met voorzichtigheid te worden gebruikt in deze situaties. Tot slot dient ketoacidose overwogen te worden bij mogelijke volumedepletie in combinatie met een metabole acidose na start van een SGLT2-remmer (Practice Points 2, 3, 4b)
Mycotische genitale infecties
De meta-analyse met gepoolde data van RCTs met SGLT2-remmers en placebo bij patiënten met en zonder DM29 rapporteert een verhoogd risico op mycotische genitale infecties bij gebruik van SGLT2- remmers ten opzichte van placebo (RR 3.57 (95% CI 3.14;4.06)). Er wordt beschreven dat de incidentie van Fournier’s gangreen te laag was in de studies om een betrouwbare risicoschatting te rapporteren (11 events in de groep behandeld met een SGLT2-remmer ten opzichte van 14 events in de placebogroep). Er is in deze meta-analyse helaas geen subgroep analyse met betrekking tot het optreden van mycotische infecties in de deelnemers zonder DM2 beschreven. Dit geldt ook voor de originele DAPA-CKD, EMPA-KIDNEY en ‘hartfalen studies’. Het blijft dus onduidelijk wat de daadwerkelijke incidentie van (ernstige) mycotische genitale infecties is bij patiënten zonder DM2 die behandeld worden met een SGLT2-remmer. Deze zou, een verhoogd infectierisico bij DM2 in acht nemend, lager kunnen zijn dan de gerapporteerde incidentie op grond van de huidige gepoolde data van deelnemers met en zonder DM2. Een mycotische infectie is over het algemeen goed te behandelen met een (in eerste instantie topicaal) anti-mycotisch middel. Het is geen reden om de SGLT2-remmer direct te staken. Heroverweeg voortzetting van de SGLT2-remmer bij frequente recidieven of ernstige mycotische infecties (Practice Point 4a).
Urineweginfecties
De meta-analyse met gepoolde data van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 rapporteert een (matig) verhoogd risico op urineweginfecties (UWIs) bij deelnemers behandeld met een SGLT2-remmer ten opzichte placebo (RR 1.08, 95%CI: 1.02-1.05). Aangezien ook voor deze uitkomst geen afzonderlijke analyse bij deelnemers met en zonder DM2 is verricht, blijft de daadwerkelijk incidentie van (ernstige) UWIs ten gevolge van het gebruik van een SGLT2-remmer door patiënten zonder DM2 onduidelijk en zou deze, een verhoogd infectierisico bij DM2 in acht nemend, lager kunnen zijn dan de gerapporteerde incidentie op grond van de data van patiënten met en zonder DM2.
Amputatie van de onderste ledematen
De meta-analyse met gepoolde data van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 toont een vergelijkbaar risico op amputaties bij behandeling met SGLT2-remming of placebo bij deelnemers zonder DM2.
Ten tijde van de vergoeding van dapagliflozine voor de indicatie chronische nierschade (CNS) per 1 mei 2022 waren alleen data van patiënten met CNS zonder type 2 diabetes mellitus (DM2) beschikbaar uit subgroepen van de DAPA-CKD studie7 en de ‘hartfalen studies’ (EMPEROR-REDUCED, EMPEROR-PRESERVED en DAPA-HF)9. Naast het feit dat de populaties uit die ‘hartfalen studies’ werden gekenmerkt door de aanwezigheid van HFpEF of HFrEF, waren veel uitkomstmaten betreffende effectiviteit en veiligheid van SGLT2-remmers niet gespecificeerd voor de subgroep van deelnemers zonder DM2.
Bovendien waren in de DAPA-CKD studie voornamelijk patiënten met CNS-stadia met een (zeer) hoog KDIGO-risico geïncludeerd (grotendeels proteïnurie stadium A3). Hierdoor waren er onvoldoende data beschikbaar om de effectiviteit en veiligheid van SGLT2-remming, in dit geval dapagliflozine, af te wegen bij patiënten met CNS in de stadia met een lager risico op cardiovasculaire (CV)-ziekten en eindstadium nierfalen (‘oranje en gele’ KDIGO risico categorieën).
Sinds november 2022 is een reeks publicaties verschenen die deze afweging beter kan onderbouwen. Dit betreft de EMPA-KIDNEY trial8, een meta-analyse van RCTs met SGLT2-remmers (inclusief EMPA- KIDNEY), waarin de impact van de aanwezigheid van DM2 op renale uitkomsten werd onderzocht9, een post-hoc analyse van de DAPA-CKD studie van de subgroep met minder ernstige proteïnurie10 en een analyse van het voordeel van het gebruik van SGLT2-remmers gecombineerd met RAAS-inhibitie bij patiënten met CNS en albuminurie zonder DM2 in termen van gewonnen levensjaren zonder nierfalen11. Naast de DAPA-CKD studie en de ‘hartfalen studies’ vormen deze publicaties de basis voor de huidige leidraad, aangevuld met argumenten en overwegingen van de werkgroep.
Effectiviteit SGLT2-remmers bij patiënten met en zonder zeer hoog KDIGO risico CNS
In de DAPA-CKD studie7 werden patiënten met proteïnurie ≥ 200mg/dag en < 5g/dag geïncludeerd, die bovendien > 4 weken stabiel moesten zijn ingesteld op RAAS-inhibitie, tenzij er sprake was van een gedocumenteerde intolerantie. Van de in totaal 4,304 geïncludeerde patiënten in DAPA-CKD studie, had bijna de helft (N= 2,906, 48.3%) proteïnurie > 1g/dag (mediane UACR gehele groep: 949 mg/g). In de subgroep van deelnemers zonder DM2 (N=1,398, eGFR 42±12 ml/min/1.73m2) was de mediane UACR 870 mg/g (25e-75e percentiel range 472–1533 mg/g). In deze subgroep had circa 90% van de deelnemers (N=1,262) proteïnurie stadium A3 en de resterende N=136 proteïnurie stadium A1 of A2. In de totale groep van deelnemers zonder DM2 gebruikte 98% RAAS-inhibitie. Hoeveel van de 136 deelnemers met minder ernstige proteïnurie RAAS-inhibitie gebruikte werd niet gerapporteerd.
In een recent gepubliceerde post-hoc analyse van de DAPA-CKD studie10 is bij deze 136 deelnemers zonder DM2 met proteïnurie <300mg/dag gekeken naar de renale bescherming (jaarlijkse afname van eGFR en verandering in proteïnurie) van behandeling met dapagliflozine versus placebo. Deze groep had een gemiddelde eGFR van 42±11 ml/min/1.73m2 en een mediane proteïnurie van 245mg/g (25e-75e percentiel 207–266 mg/g); 24 van deze 136 deelnemers (18%) had proteïnurie stadium A1 (<30mg/g). Het bereiken van het gecombineerde renale eindpunt (aanhoudende >50% eGFR afname, eindstadium nierfalen of overlijden door nierfalen) was zeldzaam binnen deze groep (1 event in de dapagliflozine-groep en 3 in de placebo- groep). De achteruitgang in eGFR in de met dapagliflozine-behandelde deelnemers met proteïnurie <300mg/g was langzamer in vergelijking met de placebo-behandelde deelnemers met proteïnurie <300mg/g (verschil van 1.8 ml/min/1.73 m2 per jaar; 95% CI 0.4 -3.1) en het verschil in proteïnurie-reductie tussen de behandelgroepen was 16% (95% CI –41.8; 21.3) in de deelnemers met proteïnurie <300mg/g. Er waren geen verschillen in aantal adverse events tussen de beide groepen.
Tot slot werd ook gekeken naar de deelnemers zonder DM2 met een UACR <600 or ≥600 mg/g, hetgeen overeenkomt met proteïnurie 1 gram per etmaal. In de subgroep van 489 deelnemers met een baseline UACR <600 mg/g, hadden de deelnemers in de dapagliflozine-groep een langzamere eGFR-achteruitgang dan in de placebogroep (verschil van 0.8 ml/min/1.73m2 per jaar 95% CI 0.0; 1.6). Dit verschil was groter bij de 909 deelnemers zonder DM2 met een UACR≥ 600mg/g (1.6 ml/min/ 1.73m2 per jaar (95% CI 0.9;2.3).
Op basis van deze beperkte data uit de DAPA-CKD studie kan dus minder goed uitspraak worden gedaan over de renale winst van dapagliflozine ten opzichte van placebo bij patiënten zonder DM2 met een eGFR>25 ml/min/1.73m2 en proteïnurie < 300mg/dag, behalve dat deze geringer lijkt dan in de groep met proteïnurie >300mg/dag.
In de EMPA-KIDNEY trial8 waren 3,192 deelnemers (48.3% van de totale studiepopulatie) met minder ernstige proteïnurie (<300mg/g) geïncludeerd. Dit betrof 1,328 deelnemers (20%) met proteïnurie stadium A1 en 1,864 deelnemers (28%) met proteïnurie stadium A2. Uit een subgroepen-analyse op basis van deze proteïnurie blijkt dat het primaire eindpunt (progressie van nierziekte of overlijden door een cardiovasculaire oorzaak) minder frequent voorkwam bij deelnemers met minder ernstige proteïnurie, ten opzichte van de 3,417 (51.7%) deelnemers met proteïnurie stadium A3 (>300mg/g). Bovendien bleek dat de deelnemers met minder ernstige proteïnurie, geen (stadium A1) of niet significant (stadium A2) voordeel hadden van behandeling met empagliflozine wat betreft de primaire uitkomstmaat. Bij deelnemers met proteïnurie stadium A1 bereikte 6.3% van de deelnemers in de empagliflozine-groep de primaire eindkomstmaat, versus 6.3% in de placebogroep (RR 1.01 (95% CI 0.66;1.55). Bij proteïnurie stadium A2 was dit 7.2% in de empagliflozine-groep versus 8.3% in de placebo-groep (RR 0.91 (95%CI:0.65-1.26)). De deelnemers in de empagliflozine-groep met proteïnurie stadium A3 hadden een duidelijk voordeel van empagliflozine ten opzichte van placebo met betrekking tot het primaire eindpunt: 18.8% events in de empagliflozine-groep in vergelijking met 25.7% in de placebogroep (RR 0.67, 95%CI 0.58;0.78).
Ofschoon het in de publicatie niet is uitgesplitst, moet op basis van de inclusiecriteria van de EMPA- KIDNEY, zijn de eGFR 20-45 ml/min/1.73m2 ongeacht mate van proteïnurie OF eGFR 45-90 ml/min/1.73m2 met UACR van minimaal 200mg/g, het overgrote deel van deze deelnemers met minder ernstige proteïnurie bij randomisatie een eGFR 20-45 ml/min/1.73m2 hebben gehad. In de EMPA-KIDNEY trial zijn dus waarschijnlijk geen patiënten met KDIGO CNS stadium G3aA1 en weinig patiënten met KDIGO stadium G3aA2 vertegenwoordigd.
Een minder goede vertegenwoordiging van KDIGO CNS stadia met een lager risico en daarmee ook een onzekerder voordeel van toevoeging van empagliflozine bij deze categorie, blijkt ook uit een aanvullende subgroep analyse van de EMPA-KIDNEY trial. De kleinere groep deelnemers (N=1,672, 25%) met een laag, matig of hoog-risico KDIGO CNS categorie (groen, geel en oranje) had geen statistisch significant voordeel van empagliflozine ten opzichte van placebo met betrekking tot het primaire eindpunt, hetgeen wel het geval was bij de grotere groep deelnemers (N=4,937, 75%) met een zeer hoog risico (KDIGO categorie rood). Er waren 44 primaire eindpunten bij de 839 (5.2%) met empagliflozine behandelde deelnemers met een laag, matig of hoog KDIGO-risico, ten opzichte van 41 events bij 833 (5.0%) met placebo behandelde deelnemers met een laag, matig of hoog KDIGO- risico (RR 1.13 (95% CI 0.74;1.72)). Voor de deelnemers met een zeer hoog KDIGO-risico was dit: 388 primaire eindpunten bij 2,465 (15.7%) deelnemers in de empagliflozine groep ten opzichte van 517 events bij 2,472 (20.9%) deelnemers in de placebogroep (RR 0.69 (95%CI: 0.61;0.79)).
Dit betrof echter deelnemers met en zonder DM2. Het aandeel patiënten zonder DM2 in deze groep met minder ernstige proteïnurie is niet te achterhalen in de eerste publicatie van de EMPA-KIDNEY trial. Dit geldt ook voor het gebruik van RAAS-inhibitie en/of diuretica bij de groepen met verschillende mate van proteïnurie. In de totale studiepopulatie van de EMPA-KIDNEY werd circa 85% van de deelnemers behandeld met RAAS-inhibitie (85.7% in de empagliflozine-groep versus 84.6% in de placebogroep) en circa 42% met een diureticum (41.2% in empagliflozine-groep versus 44.0% in de placebogroep). Er was overigens geen significant verschil met betrekking tot het primaire eindpunt tussen deelnemers die wel of geen RAAS-remmer of diureticum gebruikten in de EMPA- KIDNEY studie.
De recent gepubliceerde meta-analyse van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 geeft geen (extra) informatie met betrekking tot het (cardio-)renale voordeel van patiënten met CNS zonder DM2 met minder ernstige proteïnurie.
Tot slot is met betrekking tot de inzet van SGLT2-remmers bij patiënten zonder DM2 zeer recent een publicatie verschenen met een schatting van het voordeel van behandeling met SGLT2-remmers gecombineerd met RAAS-inhibitie bij patiënten met CNS en albuminurie zonder DM2 in termen van gewonnen levensjaren zonder nierfalen in vergelijking met patiënten die deze combinatie- behandeling niet krijgen.11 Deze toont een geschatte HR van 0.35 (95% CI 0.30;0.41) in het voordeel van gecombineerde SGLT2-RAAS-remming ten opzichte van geen behandeling met SGLT2-RAAS- remming met betrekking tot het primaire samengestelde eindpunt (verdubbeling serum kreatinine, eindstadium nierfalen of overlijden). Dit vertaalt zich voor een 50-jarige patiënt naar een geschatte overleving van 17 event-vrije levensjaren (95%CI 12.4; 19.6) met deze combinatietherapie ten opzichte van 9.6 jaren (95% CI 8.4;10.7) zonder deze combinatiebehandeling. Dit komt overeen met een winst van 7.4 event-vrije levensjaren (95%CI 6.4;8.7). Deze winst was ook nog steeds aanwezig (5.3-5.8 jaren, 95%CI 4.4;6.1 respectievelijk 4.8; 6.8) indien rekening werd gehouden met een lagere therapietrouw respectievelijk een minder sterke effectiviteit van de combinatietherapie. In deze analyses zijn schattingen voor verschillende leeftijdsgroepen gemaakt (winst bij jongere mensen meer uitgesproken vanwege hogere incidentie niet-nierfalen-gerelateerd overlijden bij ouderen), maar niet voor verschillen in mate van proteïnurie of KDIGO CNS risico categorie. Dit laatste was wellicht ook niet mogelijk, gezien het feit dat de effect-schattingen gebaseerd waren op eerdere studies met RAAS-remmers met een gemiddelde baseline proteïnurie van 1500mg/g en de DAPA-CKD studie met een gemiddelde proteïnurie van circa 950mg/g.
Tot slot was de winst van gecombineerde SGLT2-RAAS-remming ten opzichte van alleen RAAS- inhibitie bij een 50-jarige patiënt 2.5 jaar (95% CI, 1.3;3.7) voor het primaire eindpunt, hetgeen het belang van combinatie van een SGLT2-remmer met een maximaal tolereerbare dosis RAAS-inhibitie verder bevestigt (zie advies 1.d van de leidraad).
Onderliggende nierziekte
Van de 4,304 deelnemers van de DAPA-CKD studie had 58% diabetische nefropathie als onderliggende nierziekte, 16% glomerulonefritis (uitgezonderd ANCA-geassocieerde vasculitis en lupus nefritis, aangezien dit aanvullende exclusiecriteria waren); 16% ischemische of hypertensieve CNS en 10% CNS door een andere of onbekende oorzaak. Een post-hoc analyse van de DAPA-CKD studie liet zien dat dapagliflozine het risico op majeure renale en cardiovasculaire events en overlijden reduceerde, ook bij de deelnemers zonder diabetische nefropathie14. Aanvullende analyses toonden vergelijkbare effecten in kleinere subgroepen met specifieke onderliggende nierziekten zoals biopt-bewezen FSGS (N=104)15 en IgA nefropathie (N=270, waarvan 94% biopt- bewezen).16
Van de 6,609 deelnemers van de EMPA-KIDNEY trial had 31% diabetische nefropathie als grondlijden, 22% een hypertensieve of renovasculaire oorzaak van CNS, 25% een glomerulaire nierziekte en 22% CNS met een andere of onbekende oorzaak. Ook in deze studie waren de cardio-renale effecten van SGLT2-remming, in dit geval empagliflozine, vergelijkbaar in de groepen met een andere onderliggende nierziekte dan diabetische nefropathie.
Tot slot toonde de recent gepubliceerde meta-analyse9 van RCTs met SGLT2-remmers bij patiënten zonder DM2 de geaggregeerde data van de DAPA-CKD en EMPA-KIDNEY trial met betrekking tot renale effecten van SGLT2-remming bij deelnemers met verschillende onderliggende nierziekten. Deze analyse toonde geen verschillen tussen de subgroepen met betrekking tot het primaire renale eindpunt (aanhoudende ≥50% eGFR-daling, bereiken van eindstadium nierfalen of overlijden door nierfalen). Ook een verdere onderverdeling van de subgroep met glomerulaire ziekten (inclusief o.a. 817 patiënten met IgA-nefropathie) toonde geen noemenswaardige verschillen. In deze meta- analyse is de subgroep-analyse met betrekking tot onderliggende nierziekte niet gepubliceerd voor de primaire cardiovasculaire uitkomstmaat (samengesteld eindpunt van overlijden aan een cardiovasculaire oorzaak of hartfalen-gerelateerde ziekenhuisopname); in de oorspronkelijke studies was hiervoor echter ook geen verschil tussen de subgroepen met verschillende nierziekten aantoonbaar.
Acute eGFR daling na start SGLT2-remmer
De frequent voorkomende daling van de eGFR (gemiddeld 3–8 ml/min per 1.73 m2) 2 tot 4 weken na start van een SGLT2-remmer, wordt veroorzaakt door remming van natrium- en glucose-reabsorptie in de proximale tubulus, hetgeen leidt tot een toename van het aanbod van natriumchloride in de distale tubulus, resulterend in toegenomen tubulo-glomerulaire feedback. Deze acute eGFR-daling betreft een farmacodynamisch effect en is reversibel na het staken van de SGLT2-remmer, ook na langdurige behandeling17,18. Op de langere termijn wordt er juist een minder progressieve achteruitgang van de eGFR ten tijde van behandeling met SGLT2-remmers in vergelijking met placebo waargenomen. Mogelijk wordt dit, naast een verbeterde tubulo-glomerulaire feedback ook veroorzaakt door andere nier-beschermende effecten van SGLT2-remmers19.
In de studies bij patiënten met DM2, bleek SGLT2-remming een acute eGFR-daling ≥10% te veroorzaken bij 30%-45% van de deelnemers. Deze acute eGFR daling was niet geassocieerd met slechtere cardio-renale uitkomsten20,21. De acute eGFR-daling van >30%, die ook als grens bij het gebruik van RAAS-inhibitie wordt gehanteerd, kwam veel minder vaak voor in deze studies met patiënten met DM2 (1.4-4.2%).
In een post-hoc analyse van de EMPA-REG OUTCOME trial20 hadden 64 met empagliflozine behandelde deelnemers (1.4%) en 20 met placebo behandelde deelnemers (0.9%) een eGFR daling ≥30% 2 weken na randomisatie. Deze groep had over het algemeen dezelfde karakteristieken als de patiënten met een eGFR-daling van 10-30%, maar wel meer co-morbiditeiten en CV-risicofactoren. De eGFR-daling bleef stabiel na 12 weken en leidde bij 1 deelnemer in de empagliflozine-groep tot staken van de behandeling na 12 weken. Deze publicatie beschrijft geen analyse naar de associatie tussen een >30% eGFR daling en adverse events.
Dit was wel het geval in een post-hoc analyse van de CREDENCE trial21. In de CREDENCE trial hadden 965 van de 2,144 (45%) canagliflozine gebruikers versus 215 van de 2,145 (10%) placebo-gebruikers een acute eGFR daling van >10% na 3 weken behandeling. Een >30% eGFR-daling trad op in N=89 (4.2%) van de gebruikers van canagliflozine ten opzichte van 39 (1.8%) van de placebo-gebruikers. Hoewel ook in deze analyse een acute eGFR daling van >10% niet geassocieerd was met slechtere uitkomsten, werd in de subgroep van deelnemers met een >30% eGFR-daling wel een verhoogd aantal adverse events (HR, 1.34, 95%CI 1.05;1.72]) en nier-gerelateerde adverse events waargenomen.
Wat betreft de associatie tussen door de SGLT2-remming geïnduceerde acute eGFR-daling en lange- termijn uitkomsten bij patiënten zonder DM2, is er een post-hoc analyse verschenen van een van de ‘hartfalen-studies’ (DAPA-HF, waarin patiënten met HFrEF en een eGFR >30 ml/min/1.73m2 werden behandeld met dapagliflozine of placebo)22, alsook een recente post-hoc analyse betreffende 4,157 deelnemers van de DAPA-CKD studie23. Beide analyses zijn gedaan met data van alle deelnemers en niet specifiek van de patiënten zonder DM2 (55% van het totale deelnemers in de DAPA-HF studie respectievelijk 33% in de DAPA-CKD studie).
In de DAPA-HF22 studie had 38.2% van de deelnemers in de dapagliflozine groep een >10% eGFR- daling twee weken na randomisatie, ten opzichte van 21% van de deelnemers in de placebo-groep. Wat betreft een >30% e-GFR daling was dit: 3.4% respectievelijk 1.3% van de deelnemers. Een acute eGFR-daling >10% was niet geassocieerd met adverse events, maar wel met betere CV-uitkomsten (primair: progressie hartfalen of overlijden aan een CV-oorzaak en secundair: opnames gerelateerd aan hartfalen en all-cause mortaliteit) en een langzamere eGFR achteruitgang tijdens follow-up in vergelijking met deelnemers met een acute eGFR-daling<10%.
De analyse van de DAPA-CKD studie23 toonde dat 1026 (49.9%) deelnemers in de dapagliflozine- groep en 494 (23.7%) deelnemers in de placebo-groep een acute eGFR-daling van >10% hadden twee weken na start van de behandeling. De patiënten met een acute eGFR-daling >10% in de dapagliflozine-groep lieten een langzamere eGFR-daling gedurende de follow-up zien, in vergelijking met deelnemers met een minder sterke eGFR-daling of stijging van eGFR na start van dapagliflozine. De acute eGFR-daling >10% was niet geassocieerd met een slechtere primaire renale uitkomst (≥ 50% eGFR daling, eindstadium nierfalen of overlijden door nierfalen of cardiovasculaire oorzaak). Adverse events in de dapagliflozine groep waren niet gerelateerd aan de mate van acute eGFR-daling in de dapagliflozine-groep. Ouderen en patiënten met een hogere bloeddruk of BMI, lager serum hemoglobine en met gebruik van diuretica hadden een hoger risico op een sterkere acute eGFR- daling na start van dapagliflozine. Slechts 144 (3.5%) deelnemers uit de dapagliflozine-groep hadden een acute eGFR daling van>30%. De associatie tussen eGFR-daling en uitkomsten op langere termijn in deze relatief kleine subgroep werd niet geanalyseerd.
Er zijn, voor zover de werkgroep kan achterhalen, geen associaties tussen SGLT2-remmer geïnduceerde eGFR-daling en uitkomsten uit de zogenoemde ‘hartfalen-studies’ gepubliceerd, behoudens die van de bovengenoemde DAPA-HF studie. Dit geldt (vooralsnog) eveneens voor de recente gepubliceerde EMPA-KIDNEY trial8, alsook de meta-analyse met gepoolde data van gerandomiseerde studies met SGLT2-remmers bij patiënten zonder DM29. Een gepoolde analyse van data uit de DAPA-CKD en EMPA-KIDNEY bij patiënten met en zonder DM2 zou hierin specifiek van meerwaarde zijn, aangezien in deze studies relatief veel patiënten met ernstigere CNS en zonder DM2 zijn geïncludeerd.
Samenvattend acht de werkgroep het momenteel onduidelijk of een standaard meting van de nierfunctie 2-4 weken na start van een SGLT2-remmer geïndiceerd is bij alle patiënten zonder DM2, of wellicht alleen van meerwaarde zou kunnen zijn bij patiënten met een verhoogd risico op volume- depletie, zoals bijvoorbeeld ouderen en/of patiënten die diuretica gebruiken. In sommige studies, overigens geen enkele met alleen data van patiënten zonder DM2, lijkt een acute eGFR-daling >10% geassocieerd met betere cardio-renale uitkomsten, hetgeen suggereert dat de acute eGFR daling ook een reflectie zou kunnen zijn van de mate van effectiviteit van de behandeling met de SGLT2- remmer. In ieder geval is op grond van de huidige literatuur een acute eGFR-daling >30% na start van een SGLT2-remmer ook geen reden tot het zonder meer staken van deze behandeling.
Hypotensie en volumedepletie
Het optreden van hypotensie of volumedepletie werd gemeld bij 1-10% van de deelnemers aan de studies met SGLT2-remmers. In de ‘hartfalen studies‘ (deelnemers met HF, een gemiddelde eGFR van 60 ml/min/1.73m2, circa 50% zonder DM2) was de frequentie van optreden van volumedepletie bij dapagliflozine of empagliflozine ongeveer 5-7%. Dit betreft dus zowel patiënten met en zonder DM2. De toegenomen diurese als gevolg van de door SGLT2-remming geïnduceerde glucosurie en natriurese, kan resulteren in een verlaging van de bloeddruk: gemiddeld systolisch 2.4 mmHg en 1.5 mmHg diastolisch voor klinisch gemeten bloeddrukken24 en 3.6 mmHg respectievelijk 1.7 mmHg voor ambulante 24-uurs metingen in de diverse studies met SGLT2-remmers bij patiënten met DM2 en wisselende achtergrond medicatie zoals RAAS-inhibitie of diuretica25.
De data betreffende patiënten met ernstigere CNS zonder DM2 en zonder ernstig hartfalen, beperkt zich tot de DAPA-CKD7 en de EMPA-KIDNEY8 studie. In de recent verschenen meta-analyse van RCTs met SGLT2-remmers bij patiënten met en zonder DM2 worden geen data betreffende hypotensie of volumedepletie gerapporteerd9.
In de DAPA-CKD-studie (N= 4,304, 33% zonder DM2, gemiddelde eGFR 45 ml/min/1.73m2 en proteïnurie 800mg/dag, 99% RAAS-inhibitie) verlaagde dapagliflozine de systolische bloeddruk met gemiddeld -3.2 (-95% CI 4.0;-2.5) mmHg bij de deelnemers met DM2 en met gemiddeld -2.3 (95%CI – 3.4;-1.2%) mmHg bij de deelnemers zonder DM27,26. In de dapagliflozine-groep werden tekenen van volumedepletie gezien bij 6.3% van de deelnemers met DM2 ten opzichte van 5.0% van de patiënten zonder DM2. Deze percentages waren lager in de met placebo behandelde groep: 4.9% respectievelijk 2.7%. Hierbij moet worden opgemerkt dat 50% van de deelnemers met DM2 diuretica gebruikte, ten opzichte van 30% van de deelnemers zonder DM2.
In de EMPA-KIDNEY8 studie (N=6609, 54% zonder DM2, gemiddelde eGFR 37.3±14.5 ml/min/1.73 m2 en proteïnurie 330mg/g, 85% RAAS-inhibitie, 42% diuretica) verlaagde empagliflozine de systolische en diastolische bloeddruk met gemiddeld −2.6±0.3 mmHg respectievelijk −0.5±0.2 mmHg ten opzichte van placebo. Resultaten m.b.t. bloeddrukveranderingen werden niet apart voor deelnemers met en zonder DM2 getoond. Over het optreden van volumedepletie werd in deze eerste publicatie van de studieresultaten eveneens niet gerapporteerd.
Hypoglykemie
Hypoglykemie ten gevolge van SGLT2-remming lijkt voornamelijk op te treden bij patiënten met DM2, waarbij de incidentie in de studies met SGLT2-remmers in het algemeen niet veel verschilde tussen de behandelgroepen en sterk afhankelijk was van het soort achtergrond glucoseverlagende therapie9. Uit de publicaties van studies met SGLT2-remmers waaraan ook patiënten zonder DM2 hebben deelgenomen, kan niet altijd goed worden achterhaald of de incidentie van hypoglykemie echt nihil was bij patiënten zonder DM2, maar deze kans is op basis van de huidige literatuur wel zeer klein. Zo werd ernstige hypoglykemie in de DECLARE, DAPA-HF en DAPA-CKD studies alleen bij de deelnemers met DM2 gezien.
De recent gepubliceerde meta-analyse met gepoolde data van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 laat zien dat er zelfs een klein verschil is in het voordeel SGLT2- remming met betrekking tot het optreden hypoglykemie bij de 42,656 met een SGLT2-remmer behandelde deelnemers ten opzichte van de 37,546 met placebo behandelde deelnemers (RR 0.89 (95% CI 0.80;0.98). Dit betrof studies met deelnemers met en zonder DM2 met een gemiddelde eGFR van 64 ml/min/1.73m2. De resultaten m.b.t. hypoglykemie waren in de meta-analyse niet voor deze groepen apart weergegeven, maar met betrekking tot de uitkomst hypoglykemie onderverdeeld naar RCTs met verschillende patiënt-karakteristieken: ‘hoog atherosclerotisch CV-risico studies’ (N=32,401, 100% deelnemers met DM2, gemiddelde eGFR 80ml/min/1.73m2; RR 0.83 (95% CI 0.71;0.96), ‘stabiel hartfalen studies’ (N=20,704, 50-55% met DM2 en 1 studie 100%, gemiddelde eGFR 62ml/min/1.73m2; RR 0.93 (95%CI 0.70;1.23) en ‘CNS-studies’ (N=25,881, 46-100% met DM2, gemiddelde eGFR 44 ml/min/1.73m2; RR 0.91 (0.79;1.05). Deze resultaten ondersteunen dat de kans op hypoglykemie bij patiënten met CNS en zonder DM2 bij behandeling met een SGLT2-remmer zeer klein is.
Ketoacidose
Net als hypoglykemie komt ketoacidose ten gevolge van het gebruik van een SGLT2-remmer nagenoeg niet voor bij patiënten zonder DM2. In dezelfde meta-analyse9 werd de incidentie van ketoacidose bij de RCTs met SGLT2-remmers vergeleken tussen deelnemers met en zonder DM2. De incidentie was in beide groepen laag. Bij de deelnemers met DM2 betrof dit 120 events bij 40,666 deelnemers (0.3%) in de SGLT2-remmer-groep ten opzichte van 47 events bij 34,085 deelnemers (0.1%) in de placebogroep. Bij de deelnemers zonder DM2 was dit 1 event bij 7,788 deelnemers (0.01%) die met SGLT2-remming behandeld werden, ten opzichte van 0 events bij 7,807 deelnemers die met placebo behandeld werden. Rekening houdend met follow-up duur van de studies, was er eenmalig een ketoacidose opgetreden bij de deelnemers zonder DM2 die behandeld werden met een SGLT2-remmer gedurende circa 30.000 patiëntjaren follow-up.
Mycotische genitale infecties
In gepoolde veiligheidsdata van de studies met SGLT2-remmers bij patiënten met DM2 werden vulvovaginitis, balanitis en soortgelijke genitale infecties gemeld bij 5,5% respectievelijk 0,6% van de deelnemers die een behandeling met een SGLT2-remmer of placebo kreeg27. De meeste infecties waren mild tot matig van ernst met een goede reactie op initiële standaardbehandeling. In de DAPA- HF, DAPA-CKD en EMPA-KIDNEY studies (met ook deelnemers zonder DM2) werd ernstige genitale infecties gezien bij 0.1 tot 0.3% van de patiënten9. In de EMPA-KIDNEY studie8 was de incidentie van ernstige mycotische infecties 0.1%, gelijk bij deelnemers in de empagliflozine respectievelijk placebo- groep en vergelijkbaar bij mannen en vrouwen. Een ernstige infectie werd gedefinieerd als een bacteriële of fungale infectie van de genitaliën of perineum, inclusief vulvovaginitis, balanitis en infecties van de huid tussen de genitaliën en anus die voldoet aan de ICH-GCP criteria voor een ernstige infectie. Er waren geen gevallen van fasciitis necroticans van het perineum (Fournier’s gangreen) in de EMPA-KIDNEY studie.
De meta-analyse met gepoolde data van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 rapporteert ook een verhoogd risico op mycotische genitale infecties: RR 3.57 (95% CI 3.14;4.06). Er wordt beschreven dat de incidentie van Fournier’s gangreen te laag was in de studies om een betrouwbare risicoschatting te rapporteren (11 events in de groep behandeld met een SGLT2-remmer ten opzichte van 14 events in de placebogroep).
Er is in deze meta-analyse geen subgroep analyse met betrekking tot het optreden van mycotische infecties in de deelnemers zonder DM2 gerapporteerd. Dit geldt ook voor de originele DAPA-CKD, EMPA-KIDNEY en ‘hartfalen studies’.
Urineweginfecties
De meta-analyse met gepoolde data van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 rapporteert een verhoogd risico op urineweginfecties (UWIs) bij deelnemers behandeld met een SGLT2-remmer ten opzichte van deelnemers behandeld met placebo (RR 1.08, 95%CI: 1.02-.105). Het risico op ernstige UWIs was nagenoeg gelijk tussen de behandelgroepen (RR 1.07, 95%CI 0.90;1.27). Een UWI werd gedefinieerd als ernstig, op basis van ICH-GCP criteria of UWIs die als gecompliceerd waren aangemerkt in de originele publicatie van de studies.
In de EMPA-KIDNEY8 studie was de incidentie van ernstige urineweginfecties gelijk in de empagliflozine en placebogroep (1.6% in beide groepen, RR 0.94 (95%CI 0.64;1.37)) en kwam vaker voor bij vrouwen. Er waren 30 ernstige UWIs bij 2,207 mannelijke deelnemers (1.4%) behandeld met empagliflozine ten opzichte van 32 ernstige UWIs bij 2,210 mannelijke deelnemers (1.4%) behandeld met placebo. Er waren 22 ernstige UWIs bij 1.097 vrouwelijke deelnemers (2.0%) die behandeld werden met empagliflozine, in vergelijking met 22 ernstige UWIs bij 1,095 vrouwelijke deelnemers (2.0%) behandeld met placebo. In de publicatie van de EMPA-KIDNEY wordt de definitie van een ernstige UWI niet beschreven. De incidentie van niet-ernstige UWIs werd ook niet gerapporteerd. Aangezien ook voor deze uitkomst geen subgroep analyse bij deelnemers met en zonder DM2 is verricht, blijft de daadwerkelijk incidentie van (ernstige) UWIs ten gevolge van het gebruik van een SGLT2-remmer door patiënten zonder DM2 onduidelijk.
Amputatie van de onderste ledematen
Vanwege een signaal van een verhoogd aantal amputaties van onderste ledematen bij de deelnemers met DM2 in de canagliflozine-groep van de CANVAS studie, is deze uitkomstmaat met betrekking tot veiligheid meegenomen in de andere studies waarin SGLT2-remmers werden vergeleken met placebo. In de daaropvolgende klinische lange-termijnstudie met canagliflozine bij patiënten DM2 en diabetische nierschade (CREDENCE) werd geen verschil in risico op amputatie van de onderste ledematen waargenomen ten opzichte van placebo. Een netwerk meta-analyse van studies bij deelnemers met DM227 toonde dat behandeling met SGLT2-remmers mogelijk resulteert in een toename van het aantal amputaties: afhankelijk van de risicogroep (eerder bewezen hart- en vaatziekten, chronische nierschade, of beide) 6-13 extra amputaties per 1000 mensen na 5 jaar behandeling. De effectschattingen waren echter onnauwkeurig, met sterk variërende betrouwbaarheidsintervallen van 2-4 minder amputaties tot 16-23 meer amputaties en de bewijskracht volgens GRADE was laag. Desalniettemin wordt in de multidisciplinaire richtlijn ‘Medicamenteuze behandeling van zeer hoogrisico patiënten met DM2’ geadviseerd om bij hetontstaan van een voetulcus de SGLT2-remmer te staken1.
Dit advies lijkt op grond van de huidige literatuur niet van toepassing op patiënten zonder DM2 die behandeld worden met een SGLT2-remmer. De meta-analyse met gepoolde data van RCTs met SGLT2-remmers bij patiënten met en zonder DM29 toont een lager absoluut risico op amputaties van onderste ledematen bij deelnemers zonder DM2 ten opzichte van deelnemers met DM2 en een vergelijkbaar risico op amputaties bij behandeling met SGLT2-remming of placebo bij patienten met DM2. Er waren 680 amputaties verricht bij 40,661 (1.7%) deelnemers met DM2 behandeld met SGLT2-remming, ten opzichte van 460 amputaties bij 34,082 (1.3%) deelnemers met DM2 behandeld met placebo (RR 1.15, 95% CI 1.02;1.30). Bij de deelnemers zonder DM2 was dit: 12 amputaties bij 7,788 (0.15%) deelnemers behandeld met SGLT2-remming, ten opzichte van 13 amputaties bij 7,807 (0.17%) deelnemers behandeld met placebo (RR 0.98, 95%CI 0.43;2.25)). De relatieve risico’s voor amputaties waren overigens niet gerelateerd aan de nierfunctie (eGFR) bij aanvang van de studies.
Kennishiaten
Ten aanzien van de inzet van SGLT2-remmers ten behoeve van cardio-renale bescherming bij patiënten met CNS zonder DM2 bestaan op dit moment onderstaande kennishiaten.
© 2022. Alle rechten voorbehouden