NFN richtlijn diagnostiek en behandeling van Minimal Change Disease bij volwassenen
Autorisatiedatum: 18-09-2025
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
Deze richtlijn is gebaseerd op hoofdstuk 5 “minimal change disease (MCD) in adults” van KDIGO glomerular diseases uit 20211
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van goede zorg voor de patiënt, van een richtlijn moet worden afgeweken.
Auteurs:
Dr. J.K.J. (Jeroen) Deegens;
Dr. R.J.H. (Rutger) Maas;
Dr. H.W. (Henk) van Hamersvelt;
Verantwoordelijk lid van de Richtlijnencommissie NFN:
Dr. H.W. (Henk) van Hamersvelt;
Dr. A.T.N. van Diepen
Geen belangenverstrengeling
De richtlijn vangt aan met een samenvatting van de relevante practice points/NFN praktijkadviezen. Deze adviezen zijn gebaseerd op de beschikbare literatuur en expert opinion en, indien mogelijk, geclassificeerd volgende de GRADE systematiek.
Alle (relevante) aanbevelingen en alle practice points zijn letterlijk in het Engels overgenomen (vet gedrukt en zoals bij KDIGO omkaderd als het een aanbeveling betreft en zonder kader bij practice points, die ook in tabelvorm of figuur weergegeven kunnen worden).
De richtlijn zal, na een korte inleiding, de aanbevelingen en/of practice points zo nodig toelichten met een korte onderbouwing. Voor de uitgebreide onderbouwing wordt verwezen naar de KDIGO richtlijn.
NB: Ter vereenvoudiging wordt steeds de term prednison gebruikt waar ook prednisolon een optie is.
Initiële behandeling (5.3)
Behandeling laat optredend recidief (5.3.1.2)
Behandeling frequent/vroeg optredend recidief of steroïdafhankelijkheid, waarbij nummers de volgorde van voorkeur van de NFN aangeven (5.3.1.1)
3.1 Tacrolimus 0,05-0.1 mg/kg/dag: verdeeld over 1 (MGA) of 2 giften/dag
3.2 Ciclosporine 3-5 mg/kg/dag: verdeeld over 2 giften/dag;
Deze NFN richtlijn op basis van de KDIGO glomerulaire ziekten 2021 vervangt het onderdeel minimal change disease van de NFN richtlijn “minimal change disease-focale glomerulosclerose” uit 2013.
Minimal change disease (MCD) is een podocytopathie, die vooral op kinderleeftijd wordt gezien, maar in 10-25% van de volwassen patiënten oorzaak van hun nefrotisch syndroom is. De pathogenese is nog onbekend, maar zowel T-cel dysregulatie en B-cellen lijken een rol te spelen. In zeldzame gevallen kan MCD een gevolg zijn van Hodgkin lymfoom of medicijnen zoals lithium en NSAID’s. Deze NFN richtlijn geeft de Nederlandse behandelaren handvatten voor de behandeling van deze relatief zeldzame ziekte op basis van KDIGO 2021 aangevuld met de meest recente wetenschappelijke inzichten en praktijkervaring van Nederlandse experts op dit gebied.
Waar mogelijk wordt het wetenschappelijk bewijs voor de aanbevelingen gebaseerd op GRADE systematiek. Bij ontbreken van bewijs uit (gerandomiseerde) onderzoeken zijn de aanbevelingen gebaseerd op expert opinion en ondergebracht in practice points.
Practice Point 5.1.1: MCD in adults can be diagnosed only with a kidney biopsy.
KDIGO onderbouwing:
De diagnose minimal change disease (MCD) kan niet gesteld worden o.b.v. klinische gegevens alleen. Het nierbiopt is een essentiële aanvulling. Het nierbiopt toont typisch geen tot zeer weinig afwijkingen bij lichtmicroscopie en immunofluorescentie met volledige voetjesversmelting zonder deposities of GBM afwijkingen bij elektronenmicroscopie.
Commentaar:
Minimal Change Disease is een diagnose per exclusionem. Er kan sprake zijn van sampling error waardoor de glomeruli met de typische kenmerken van focale segmentale glomerulosclerose (FSGS) worden gemist. Het is noodzakelijk dat de diagnose wordt gesteld op basis van een volledig bewerkt biopt (LM, IF en EM). Bij EM mag er geen sprake zijn van GBM afwijkingen of fibrillaire deposities en moet er sprake zijn van volledige voetjesversmelting. Een recente studie suggereert dat anti-nefrine antistoffen een rol spelen in de pathogenese van MCD. Bij immunofluorescentie wordt in dat geval een minimale hoeveelheid IgG gezien in een gestippeld patroon. Op dit moment is de klinische betekenis hiervan nog onduidelijk en heeft dit geen rol in de diagnostiek.
Practice Point 5.2.1: Long-term kidney survival is excellent in patients with MCD who respond to glucocorticoids, but less certain for patients who do not respond.
KDIGO onderbouwing:
Steroïde-gevoelig MCD ontwikkelt zich zelden tot nooit tot chronische nierschade, alhoewel acute nierinsufficiëntie door massale proteïnurie relatief vaak voorkomt. Ongeveer 10-20% van de volwassenen met MCD is steroïde-resistent. Bij herhaling van het nierbiopt wordt bij een aanzienlijk aantal van deze patiënten FSGS-laesies gezien. Dit gaat gepaard met een slechtere prognose. De behandeling van steroïde-resistente FSGS wordt besproken in KDIGO glomerulaire ziekten hoofdstuk 6 (welke ook in de vorm van een NFN richtlijn zal worden gepubliceerd).
Commentaar:
Als patiënten met een nefrotisch syndroom zich presenteren met acute nierinsufficiëntie dan is er vrijwel altijd sprake van een minimal change nefropathie. De reden hiervan is onduidelijk, al wordt gespeculeerd over intrarenaal oedeem, lage filtratiefractie etc. Meestal zal er sprake zijn van acute tubulusnecrose, waarschijnlijk als gevolg van de overbelasting van het tubulaire apparaat met eiwitten uit de urine. Risicofactoren zijn een hogere leeftijd, mannelijk geslacht en hypertensie. Minimal change nefropathie wordt gekenmerkt door het heel snel optreden van abrupte proteïnurie. Alhoewel in de literatuur wel patiënten zijn beschreven waarbij de acute nierinsufficiëntie herstelde na behandeling met alleen albumine en diuretica, raden wij af om de behandeling te beperken tot conservatieve therapie alleen. Omdat de proteïnurie waarschijnlijk een belangrijke rol speelt bij het optreden van de acute nierinsufficiëntie/acute tubulusnecrose wordt geadviseerd terstond te starten met prednisonbehandeling. Bij patiënten met een snel progressieve nierinsufficiëntie en grote kans op (tijdelijke dialyse) kan behandeling met 3 giften methylprednisolon worden overwogen.
Bij patiënten met MCD is ook sprake van een verhoogd risico op acute nierinsufficiëntie na start van een ACEi. Kleine veranderingen in de perfusiedruk veroorzaken dan waarschijnlijk acute nierinsufficiëntie of dragen daar flink aan bij.
NFN praktijkadvies:
Start bij de behandeling van een patiënt die zich presenteert met een acuut ontstaan nefrotisch syndroom met oedeem eerst met diuretica en laat de ACEi in eerste instantie achterwege, in afwachting van verdere diagnostiek en behandeling van het oedeem.
Voor de algemene behandeling van het nefrotisch syndroom verwijzen wij naar de NFN richtlijn algemene principes van behandeling gebaseerd op hoofdstuk 1 van de KDIGO richtlijn glomerulaire ziekten.
|
Recommendation 5.3.1: We recommend high-dose oral glucocorticoids for initial treatment of MCD (1C). |
Practice Point 5.3.1: Algorithm for the initial treatment of MCD in adults (Figuur 44)

KDIGO onderbouwing:
Hoewel onbehandelde MCD spontaan in remissie kan gaan, is dit relatief ongebruikelijk. Bij ongeveer 50-60% treedt binnen 2-3 jaar remissie op, maar is er vanzelfsprekend aanzienlijke morbiditeit geassocieerd met persisterende nefrose, inclusief infecties, trombo-embolische events en hyperlipidemie. MCD reageert doorgaans op glucocorticoïden, waarbij meer dan 80% van de patiënten in remissie komt. Observationele studies rapporteren consistent een hoge respons op glucocorticoïden als initiële therapie voor MCD bij volwassenen. Nefrotisch syndroom bij kinderen en MCD bij volwassenen lijken qua pathogenese vergelijkbaar. Talrijke hoogwaardige studies bij kinderen tonen aan dat glucocorticoïden zeer effectief zijn voor de behandeling van nefrotisch syndroom bij kinderen. Daarom is het waarschijnlijk dat de voordelen van behandeling met glucocorticoïden bij kinderen zich ten minste gedeeltelijk uitstrekken tot volwassenen. Bij kinderen hebben verschillende RCT’s uitstekende remissiepercentages aangetoond met glucocorticoïden die gedurende 8-12 weken werden toegediend. KDIGO is daarom van oordeel dat de potentiële voordelen van behandeling met hoge doses glucocorticoïden bij bijna alle patiënten met MCD aanzienlijk opwegen tegen het risico op schade. Hoewel MCD bij volwassenen vergelijkbaar is met nefrotisch syndroom bij kinderen, is de respons op behandeling met glucocorticoïden bij volwassenen trager en gaat derhalve gepaard met een slechtere prognose.
Commentaar:
Spontane remissies zijn beschreven bij MCD, en het percentage remissies kan wel oplopen tot meer dan 20% indien patiënten zonder behandeling worden vervolgd gedurende 12 maanden of meer. Bij patiënten met een eenvoudig te behandelen nefrotisch syndroom zonder tekenen van (acute) nierinsufficiëntie is er derhalve geen reden voor overhaaste start van prednison behandeling. Deze patiënten moeten wel een gestage toename van het serum albumine laten zien. In een Nederlandse studie bereikten 13 patiënten (10%) een spontane remissie.2 Bij 8 patiënten was na 3 maanden het serum albumine gestegen naar ≥ 30 g/l. De mediane tijd tot een partiele remissie was 13 weken (IQR 4-51) weken. Er kan dus langer gewacht worden dan 3 maanden, zolang het serum albumine blijft stijgen en het nefrotisch syndroom makkelijk te behandelen blijft bij een stabiele nierfunctie.
In het algemeen wordt aangenomen dat MCD per definitie steroïdgevoelig is en dat behandeling moet leiden tot een complete remissie. Indien dit niet gebeurt moet een andere oorzaak worden overwogen (FSGS, amyloïdose).
Bij relatieve contra-indicaties tegen steroïden zoals obesitas, slecht gereguleerde diabetes mellitus en ernstige psychiatrische aandoeningen kan overwogen worden om alternatieve vorm van immunosuppressie te geven (Zie hierboven figuur 44, Practice Point 5.3.5).
NFN praktijkadvies:
Overweeg start van prednison behandeling tot wel meerdere maanden uit te stellen bij patiënten met MCDmet een eenvoudig te behandelen nefrotisch syndroom zonder tekenen van acute nierinsufficiëntie zo lang als die een geleidelijke spontane stijging van het serum albumine laten zien.
Practice Point 5.3.2: High-dose glucocorticoid treatment for MCD should be given for no longer than 16 weeks.
KDIGO onderbouwing:
Ondanks het gebrek aan bewijs uit RCT’s, beveelt KDIGO een maximale duur van 16 weken aan om de patiënt de kans te geven remissie te bereiken. Deze aanbeveling is gebaseerd op observationele studies die suggereren dat bij volwassenen een langere behandeling voor MCD nodig is dan bij kinderen. Slechts 50% van de volwassenen reageert na 4 weken glucocorticoïd behandeling, maar nog eens 10%-25% reageren alsnog binnen een totale behandelduur van 16 weken.
NFN praktijkadvies:
Overweeg een alternatieve diagnose zoals FSGS of amyloïdose indien met 16 weken steroïden geen complete remissie bereikt wordt en overleg in dat geval laagdrempelig met een expertisecentrum.
Practice Point 5.3.3: Begin tapering of glucocorticoids 2 weeks after complete remission.
KDIGO onderbouwing:
Het optimale protocol voor het afbouwen van glucocorticoïden na remissie bij volwassenen is niet bekend. Over het algemeen wordt met het afbouwen van glucocorticoïden begonnen nadat remissie is bereikt. In 2 RCT’s bij kinderen was het risico op een recidief nefrotisch syndroom vergelijkbaar bij een initiële steroidduur van 2-3 maanden vergeleken met initiële therapie gedurende 6 maanden. Er zijn geen studies die een snelle versus een langzamere afbouw van glucocorticoïden bij volwassenen vergelijken. In case series worden glucocorticoïden doorgaans afgebouwd met 5-10 mg/week nadat remissie is bereikt, gedurende een totale periode van ongeveer 24 weken. Het is belangrijk om bij patiënten te letten op bijwerkingen van glucocorticoïden en alternatieve middelen te overwegen als de bijwerkingen invaliderend worden of als remissie niet is bereikt.
Commentaar:
Recidieven treden vaak op bij te snel afbouwen, vandaar het advies om dit langzaam te doen.
NFN praktijkadvies:
Bouw na het bereiken van een complete remissie de prednison in principe geleidelijk af over een periode van 6 maanden.
Practice Point 5.3.4: Although daily oral glucocorticoids are used most often to treat MCD, the route and frequency of administration can be individualized to patient needs.
KDIGO onderbouwing:
De rol van intravenous methylprednisolone gevolgd door een lagere dosis orale prednison versus een standaarddosis orale prednison alleen werd vergeleken in twee RCT’s. Deze benaderingen bleken niet te verschillen wat betreft uiteindelijke remissie en daaropvolgende recidiefpercentages.
In een studie waarin prednison 1mg/kg/dag werd vergeleken met 2mg/kg om de dag gevolgd door een afbouw, was er geen significant verschil in complete remissies, de tijd tot remissie, het recidiefpercentage, de tijd tot het eerste recidief of bijwerkingen.
Commentaar:
De initiële behandeling bestaat uit prednison 1 mg/kg /dag (max 80 mg/dag) of 2 mg/kg om de dag (max 120 mg om de dag). Hierbij geeft de NFN de voorkeur aan starten met 1 mg/kg/dag. Mede gezien behandeling om de dag gebaseerd is op 2 kleine studies en dagelijkse inname de therapietrouw kan bevorderen.
Intraveneus methylprednisolon werkt sneller in vergelijking met oraal prednison. Een recente Chinese studie vergeleek 2 weken methylprednisolon 0.8 mg/kg/dag gevolgd door oraal prednison 1 mg/kg/dag met oraal prednison 1 mg/kg/dag. Het percentage complete remissies na 2 weken behandeling was significant hoger in de groep behandeld met methylprednisolon. Na 4 en 8 weken was er geen verschil meer in het percentage complete remissies.3
Behandeling met intraveneus methylprednisolon is een goede optie voor patiënten met een acute nierinsufficiëntie of een ernstig nefrotisch syndroom met massaal oedeem, waarbij de opname van oraal prednison verminderd kan zijn. Hierbij kan gekozen worden voor intraveneuze toediening gedurende 3 dagen met 500-1000 mg per dag (afhankelijk van het gewicht van de patiënt zonder oedeem). Bij deze patiënten moet de behandeling vervolgens wel minimaal 4 weken gecontinueerd worden met hoge dosis oraal prednison tot een complete remissie bereikt is.
NFN praktijkadviezen:
Practice Point 5.3.5: For patients in whom glucocorticoids may be relatively contraindicated, consider initial therapy with cyclophosphamide, a CNI, or MMF (Figuur 45).
KDIGO onderbouwing:
Er zijn weinig studies naar glucocorticoïdsparende of glucocorticoïdvrije behandelschema’s voor de intitiele behandeling van MCD. Alternatieve schema’s worden overwogen bij patiënten met relatieve contra-indicaties (bijv. ernstige hyperglykemie, osteoporose of hoog risico op psychiatrische ontregeling) of die niet bereid zijn glucocorticoïden te gebruiken. Cyclofosfamide en ciclosporine worden geassocieerd met remissiepercentages van ongeveer 75% ondanks de beperkte ervaring bij dit ziektebeeld (Figuur 45). In een RCT was mycofenolaat met een verlaagde dosis prednison (0,5mg/kg/dag, maximaal 40mg per dag) vergelijkbaar met conventionele hoge dosis prednison alleen (1mg/kg/dag, maximaal 80mg per dag) voor het bereiken van remissie met bovendien vergelijkbare recidiefpercentages en frequentie van ernstige bijwerkingen. In een RCT waarin oraal tacrolimnus 0,05mg/kg tweemaal daags werd vergeleken met prednison 1mg/kg/dag tot maximaal 60mg, waren de percentages complete remissie en recidief niet verschillend tussen de twee armen. Rituximan (4-wekelijks 375mg/m2) werd gebruikt om 6 patienten met MCD te behandelen als eerstelijnsbehandeling, waarbij 5 van de 6 patienten complete remissie ondergingen en 1 patient een afname van 75% in proteinurie ervoer. Geen enkele patient kreeg een recidief tijdens de follow-up van 8-36 maanden, ondank het herstel van het aantal B-cellen.
Commentaar:
In de Nederlandse setting wordt voor de initiële behandeling als alternatief voor steroïden een calcineurineremmeraanbevolen. Hierbij heeft tacrolimus de voorkeur gezien dit minder nefrotoxisch is in vergelijking met ciclosporine. Zie voor dosering Figuur 45 onder practice point 5.3.5. Bij start van de behandeling moet rekening gehouden worden met de nierfunctie. Geadviseerd wordt om een calcineurineremmer alleen te starten in geval van een normale nierfunctie voor de leeftijd (>p5, zie bijlages 2a en 2b).4 5 Hierbij moet ook meegewogen worden dat in geval van een nefrotisch syndroom de tubulaire kreatinine secretie veranderd is en zowel de kreatinineklaring als de eGFR op basis van kreatinine de eGFR met 50% of meer kunnen overschatten.6
Bij patiënten met massaal oedeem is het advies om, naast de tacrolimus, kortdurende behandeling te starten met prednison oraal (1 mg/kg/dag) of methylprednisolon intraveneus 0,8 mg/kg/dag gedurende 10 dagen om sneller het oedeem en de proteïnurie te verminderen.
Het remissiepercentage ligt lager bij cyclofosfamide. Dit middel is vooral effectief bij een steroïd-gevoelig nefrotisch syndroom. Bij een deel van de patiënten met MCD in het nierbiopt blijkt tijdens behandeling sprake van steroïdresistentie wat duidt op focale segmentale glomerulosclerose. Zonder voorafgaande behandeling met prednison is deze groep niet te identificeren.
Behandeling met mycofenolaat mofetil moet gecombineerd worden met een lagere dosering prednison. Dit is gebaseerd op een RCT waarin mycofenolzuur en prednison 0.5 mg/kg/dag, max 40 mg) werd vergeleken met de standaardbehandeling met prednison 1 mg/kg/dag. Deze studie toonde geen verschil in het percentage complete remissies na 8 weken: 82.6% versus 70% voor respectievelijk mycofenolzuur + prednison en prednison monotherapie. Hoewel deze studie niet was opgezet als een equivalentiestudie, lijkt behandeling met mycofenolzuur en een lage dosis prednison wel effectief.
Er is nog weinig bekend over initiële behandeling met rituximab bij minimal change disease. Ook hiervoor geldt dat deze behandeling vooral effectief is bij een steroïdgevoelig nefrotisch syndroom.
NFN praktijkadviezen:
Een minderheid van de patiënten met een MCD ontwikkeld een recidief na een complete remissie. Ongeveer 33% van de patiënten ontwikkelt frequente recidieven (11-29%) of wordt steroïd-afhankelijk (14-30%). Definities van remissie en terugval die nuttig zijn bij de classificatie van MCD staan in Figuur 46.
Practice Point 5.3.1.2: Treat infrequent relapses with glucocorticoids (Figure 46).
KDIGO onderbouwing:
Infrequente recidieven kunnen opnieuw met glucocorticoïden worden behandeld. De dosis en de duur van de glucocorticoïdtherapie bij patiënten met een recidief nefrotisch syndroom zijn nog niet volledig onderzocht. In een onderzoek werden patiënten minimaal 7 dagen behandeld met 20-30mg prednison of aanvullend met cyclofosfamide totdat de proteïnurie weer genormaliseerd is. Dit suggereert dat hoge doses glucocorticoïden conform de initiële behandeling van MCD, mogelijk niet nodig zijn. Bij langdurige en herhaalde kuren kan de kans op cumulatieve bijwerkingen (bijv. hyperglykemie en osteoporose) optreden. Een RCT naar de behandeling van volwassen patiënten met MCD bij hun eerste recidief van MCD vergeleek ciclosporine in combinatie met prednison met prednison alleen en toonde lagere proteïnurie, een hoger serum albumine en een kortere tijd tot remissie in het voordeel van de ciclosporinegroep gedurende een follow-up periode van 6 maanden.
Commentaar:
De definitie van (in)frequent recidiverende recidieven (twee of meer recidieven per 6 maanden of vier of meer recidieven per 12 maanden) is niet goed toepasbaar bij volwassenen, aangezien de initiële behandelduur met prednison minimaal 24 weken bedraagt.
Indien een recidief optreedt langere tijd na het staken van de behandeling (> 6 maanden) kan opnieuw prednison gegeven worden. De keuze voor behandeling met prednison is mede afhankelijk van eerdere bijwerkingen zoals hyperglycemie/diabetes mellitus, botverlies en ontwikkelen, iatrogene Cushing met ongewenste cosmetische effecten (striae) etc. Bij steroïdafhankelijkheid of snel optreden van recidieven (< 6 maanden) die niet in aanmerking komen voor kortdurend behandeling met prednison is het van belang om een stabielere remissie te induceren met steroïdsparende medicatie (zie Practice Point 5.3.1.1) .
In geval van een mild recidief (normale nierfunctie, geen massaal oedeem), met name bij aanwezigheid van een uitlokkend moment (bv infectie), binnen een jaar na staken van de prednison, kan kortdurende behandeling met een lagere dosering prednison (30 mg) worden overwogen. Er moet dan wel na 7 dagen sprake zijn van een goede respons. Hierbij moet de patiënt goed worden vervolgd en geïnstrueerd om bij toename van oedeem en/of gewicht direct contact op te nemen gezien de kans op het ontstaan van een acute nierinsufficiëntie bij een progressief nefrotisch syndroom.
Practice Point 5.3.1.1: Algorithm for treatment of frequently relapsing (FR)/steroid-dependent (SD) MCD in adults (Figure 47)
Recommendation 5.3.1.1: We recommend cyclophosphamide, rituximab, CNIs, or mycophenolic acid analogs (MPAA) for the treatment of frequently relapsing/steroid-dependent MCD, rather than prednisone alone or no treatment (1C).
KDIGO onderbouwing:
Deze aanbeveling hecht relatief meer waarde aan het vermijden van morbiditeit die gepaard gaat met langdurige blootstelling aan glucocorticoïden bij FR/SD (frequent-relapsing/steroid-dependent) MCD. Er wordt relatief minder waarde gehecht aan het bewijs van lage kwaliteit dat de werkzaamheid van cyclofosfamide, rituximab, CNI’s en mycofenolzuuranalogen (MPAA) ondersteunt in figuur 47.
Observationele studies en kleine RCT’s toonden aan dat alle vier de categorieën middelen het recidiefpercentage verlagen en remissie induceren bij volwassen patiënten met FR/SD MCD (figuur 48). De werkzaamheid varieert van 70% tot 90% blijvende remissies. Over het algemeen worden deze middelen gestart na het induceren van remissie met glucocorticoïden. Het is niet altijd mogelijk om glucocorticoïden volledig te staken bij patiënten die een onderhoudsbehandeling met glucocorticoïden hebben gehad, gezien de mogelijkheid van bijniersuppressie.
Cyclofosfamide: is traditioneel het voorkeursmiddel in de tweede lijn. Deze praktijk is afgeleid uit klinische studies bij kinderen, aangezien er relatief weinig gegevens beschikbaar zijn bij volwassenen. De risico’s op onvruchtbaarheid, hoewel klein, moeten worden aangepakt bij patiënten in de vruchtbare leeftijd. Een enkele kuur orale cyclofosfamide gaat bij de meeste patiënten gepaard met remissie. Langdurige behandeling (> 12 weken) en herhaalde kuren met cyclofosfamide dienen te worden vermeden vanwege cumulatieve toxiciteit. Cyclofosfamide wordt vaak geassocieerd met duurzamere remissiepercentages dan CNI. Vergeleken met 8 weken therapie, kan 12 weken behandeling met cyclofosfamide gepaard gaan met duurzamere remissies bij SD MCD.
CNI’s: in observationele studies en 1 RCT zijn CNI’s geassocieerd met remissie bij 70%-90% van de patiënten met FR/SD MCD. De recidiefpercentages zijn echter hoog en langdurige therapie kan nodig zijn wanneer patiënten terugvallen tijdens dosisverlaging. Gezien de relatief lange ervaring met CNI’s kunnen deze geneesmiddelen de voorkeur hebben bij patiënten die terugvallen na een kuur met cyclofosfamide of bij patiënten die het alkylerende middel liever vermijden vanwege onvruchtbaarheidsproblemen. De waarde van het monitoren van de geneesmiddelspiegels van CNI is onzeker. Oudere studies gebruikten vaste, op gewicht gebaseerde doses, terwijl recentere rapporten streefwaarden voor de geneesmiddelspiegels gebruikten.
MMF: was effectief in kleine, ongecontroleerde studies bij patiënten met FR/SD MCD met remissiepercentages in het bereik van 65%-85%. Gezien deze beperkte ervaring kunnen de MPAA’s mogelijk een rol spelen bij patiënten die terugvallen ondanks cyclofosfamide en CNI’s, en wanneer rituximab niet beschikbaar is.
Rituximab: is effectief in observationele studies bij patiënten die glucocorticoïden-afhankelijk zijn, met of zonder andere immunosuppressieve onderhoudstherapieën. Over het algemeen ligt de werkzaamheid van rituximab bij het induceren van remissie tussen 65% en 100%, en het wordt met name geassocieerd met een vermindering van het aantal recidieven en een vermindering van het aantal immunosuppressieve medicijnen. De ervaring met rituximab is echter beperkt en de werkzaamheid/risico’s op lange termijn bij deze populatie zijn onbekend.
De keuze voor de behandeling van FR/SD MCD kan worden ingegeven door de voorkeur van de patiënt, bijwerkingen van medicijnen, kosten en beschikbaarheid. Er is namelijk beperkt bewijs dat de ene medicijnklasse beter is dan de andere.
Commentaar:
Voor doseringsadviezen zie ook KDIGO figuur 45 en mede voor volgorde van voorkeur NFN tabel in samenvatting met praktijkadviezen voor initiële behandeling van MCD en de mogelijk optredende recidieven.
Prednison: tenzij er sprake is van een contra-indicatie, wordt bij voorkeur eerst een remissie geïnduceerd met prednison. Na bereiken van een remissie kan de prednison na start van steroidsparende immunosuppressivum sneller worden afgebouwd. Er zijn geen gerandomiseerde studies verricht hoe prednison moet worden afgebouwd. Afhankelijk van de verwachte snelheid van respons van het steroidsparende immunosuppressivum is een afbouwadvies gegeven.
Cyclofosfamide Behandeling met cyclofosfamide gedurende 3 maanden is jarenlang de eerste keuze steroïdsparende behandeling geweest en blijft een goede optie voor het induceren van een langdurige remissie bij patiënten zonder kinderwens. Een behandeling van 8 weken met de aangegeven dosering is veilig ook vanuit oogpunt van fertiliteit. Wel kan deze behandeling maar eenmalig worden gegeven en de toxiciteit t.a.v. fertiliteit is cumulatief, dus zodra een patiënt ooit eenmalig is behandeld met cyclofosfamide kan pas een volgende behandeling plaatsvinden als er geen kinderwens meer is. Bij mannen met kinderwens kan semenpreservatie worden overwogen, aangezien dit een weinig belastende optie is. Indien er geen contra-indicaties zijn wordt, op basis van studies in kinderen, geadviseerd om de cyclofosfamide te starten nadat initieel met prednison gedurende 2-4 weken een remissie is bereikt. Hierna kan de prednison worden afgebouwd met 10 mg per 2 weken tot 0,15 mg/kg/dag. Vanaf 0,15 mg/kg/dag: dosis 1 maal per 2-4 weken verlagen met 2,5 mg.
De kans op een recidief bij volwassenen na gebruik van cyclofosfamide is ongeveer 30-50% na 5 jaar.
Calcineurineremmers Bij contra-indicatie tegen cyclofosfamide, eerdere behandeling met cyclofosfamide of indien de patiënt geen behandeling met cyclofosfamide wenst, is een calcineurineremmer een goede optie.
Calcineurineremmers zijn effectief bij MCD, maar leiden vrijwel nooit tot een blijvende remissie. De recidiefkans binnen een jaar na staken van een korte behandeling bedraagt meer dan 80%. Daarom adviseert de KDIGO om tenminste een jaar te behandelen alvorens langzaam af te bouwen met 25% per 3 maanden. Het advies is om vooral in het begin dalspiegels te controleren om te hoge dalspiegels en daaraan gerelateerde nefrotoxiciteit te voorkomen.
Indien het serum kreatinine tijdens behandeling > 25-30% stijgt t.o.v. de uitgangswaarde ondanks dalspiegels op de streefwaarde, moet de calcineurineremmer vervangen worden door een ander immunosuppressief middel.
Geadviseerd wordt om een calcineurineremmer alleen te starten in geval van een normale nierfunctie voor de leeftijd (>p5; zie tabel 1a en 1b) en bij een nefrotisch syndroom rekening te houden met overschatting van de op kreatinine gebaseerde eGFR/kreatinineklaring in geval van een nefrotisch syndroom (zie ook punt 5.3.5).
Na bereiken van een complete remissie kan de prednison in 4-6 weken worden afgebouwd. Een langer afbouwschema kan nodig zijn in geval van een verhoogde kans op bijnierschorsinsufficiëntie
Mycofenolaat mofetil (MMF) wordt wel gebruikt maar lijkt minder effectief. Alhoewel de studies onvoldoende power hebben lijkt de recidiefkans met MMF therapie groter dan na calcineurineremmer behandeling. In een studie bij kinderen werd gevonden dat de kans op een recidief tijdens behandeling minder is als gestreefd wordt naar hoge MMF spiegels (MPA-AUC >50 h*mg/L)7.Er is een aantal patiënten dat ondanks behandeling blijft recidiveren. Na bereiken van een complete remissie kan de prednison in 4-6 weken worden afgebouwd. Een langer afbouwschema kan nodig zijn in geval van een verhoogde kans op bijnierschorsinsufficiëntie
Rituximab In Nederland wordt rituximab op dit moment vergoed indien cyclofosfamide, mycofenolaat mofetil of een calcineurineremmer ineffectief is, niet verdragen wordt of gecontra-indiceerd is. Voor deze patiënten is Rituximab een goede optie. Er zijn geen RCT’s, maar de case series en case reports geven aan dat Rituximab bij deze patiënten meestal leidt tot een remissie met een duur van 6-12 maanden of zelfs langer. Er kan gekozen worden voor twee keer 1 gram met een interval van twee weken of vier keer een wekelijkse gift van 375 mg/m2. Dosering op geleide van CD19 cellen is minder goed onderzocht.
Een recidief > 6 maanden na behandeling kan opnieuw behandeld worden met rituximab. Hierbij is het advies om dezelfde dosering te geven (twee keer 1 gram of vier keer 375 mg.m2). Het advies in de KDIGO richtlijn om bij een nieuw recidief maar één gift te geven is niet gebaseerd op onderzoek. In geval van een vroeg recidief (< 6 maanden na behandeling) moet nagegaan worden of er sprake is van therapieresistentie of vroeg herstel van CD19/20 B-cellen. Er zijn geen gegevens over onderhoudsbehandeling met rituximab. Zowel case series als case reports tonen onder andere een verhoogde kans op inflammatoire darmziekten en een hypogammaglublinemie bij langdurig gebruik van rituximab.8
NFN praktijkadvies:
Overleg laagdrempelig met een expertisecentrum als patiënten niet reageren op therapie of recidieven houden onder één of meerdere van de mogelijke immuunsuppressieve behandelingen.

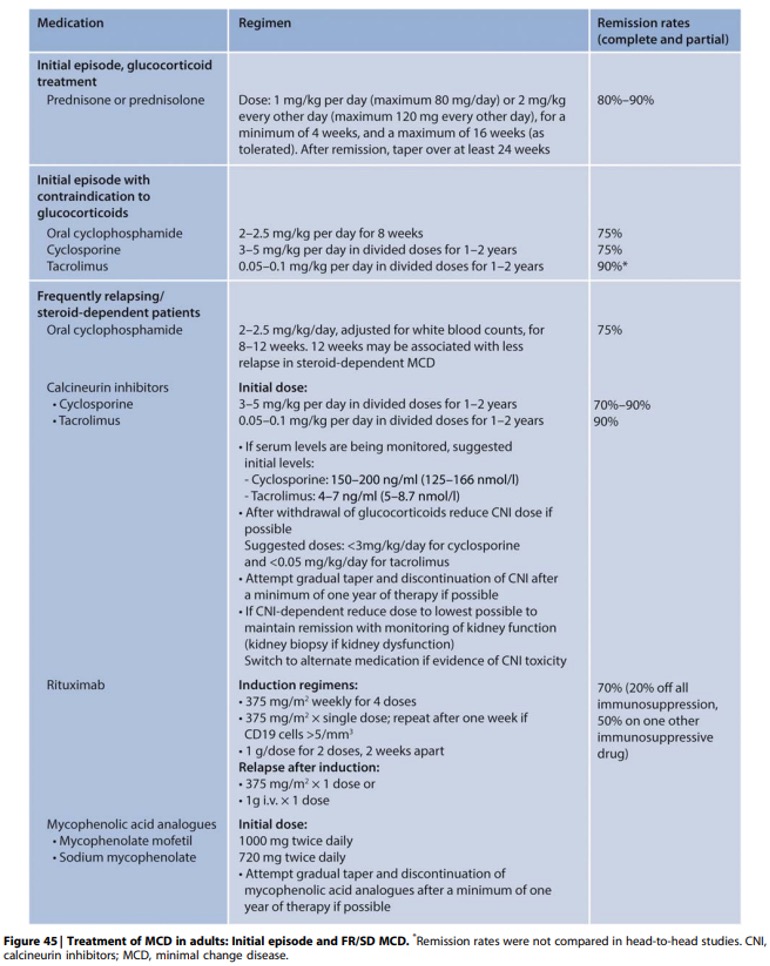
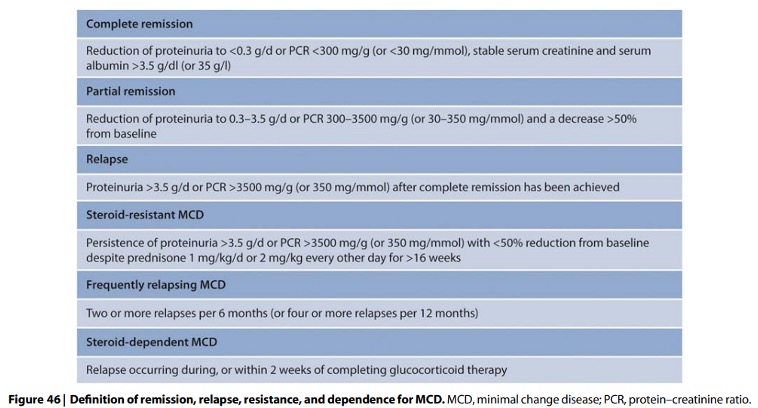
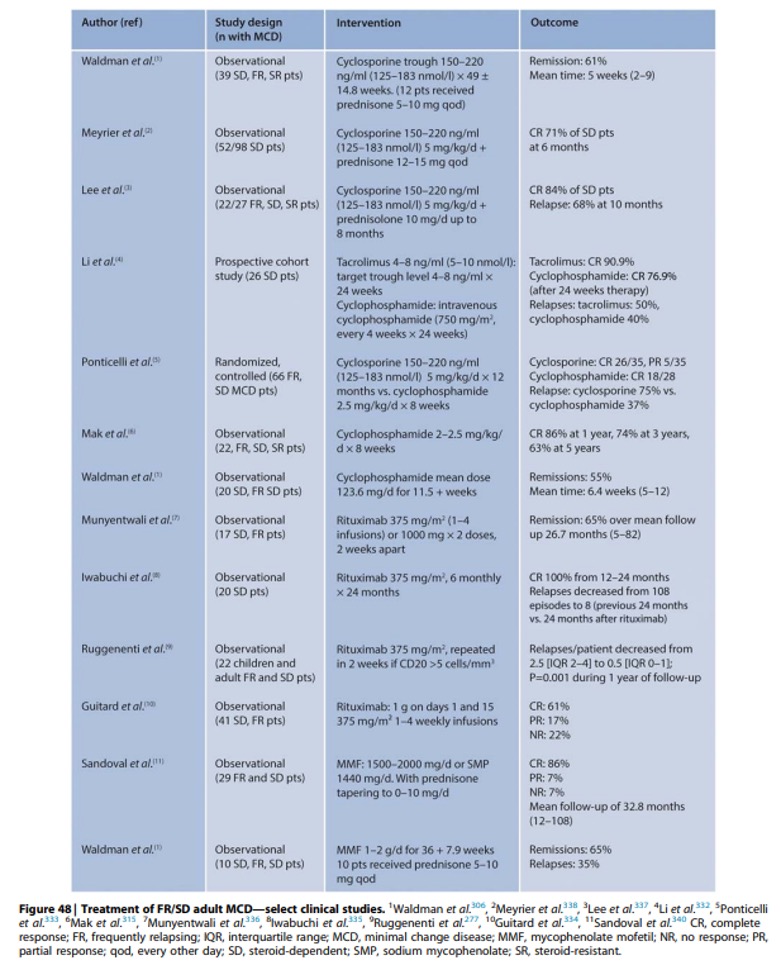
Table 1a: Estimated GFR in non-diseased caucasian males of the Nijmegen Biomedical Study4
|
Age (yrs) |
N |
Mean ± SD |
Range |
P5 |
P25 |
P50 |
P75 |
P95 |
|
18 – 24 |
94 |
114 ± 16 |
80 – 164 |
85 |
102 |
113 |
126 |
142 |
|
25 – 29 |
96 |
106 ± 17 |
74 – 148 |
82 |
92 |
102 |
117 |
137 |
|
30 – 34 |
118 |
98 ± 17 |
70 – 161 |
74 |
86 |
96 |
107 |
125 |
|
35 – 39 |
125 |
97 ± 18 |
67 – 141 |
71 |
83 |
96 |
109 |
130 |
|
40 – 44 |
143 |
96 ± 16 |
58 – 150 |
73 |
85 |
95 |
106 |
125 |
|
45 – 49 |
160 |
94 ± 17 |
54 – 148 |
70 |
82 |
93 |
105 |
123 |
|
50 – 54 |
143 |
89 ± 15 |
49 – 145 |
65 |
79 |
88 |
100 |
113 |
|
55 – 59 |
158 |
87 ± 16 |
29 – 142 |
64 |
76 |
84 |
96 |
114 |
|
60 – 64 |
149 |
86 ± 21 |
52 – 276 |
65 |
75 |
82 |
95 |
111 |
|
65 – 69 |
154 |
85 ± 19 |
55 – 217 |
62 |
73 |
84 |
94 |
114 |
|
70 – 74 |
102 |
81 ± 15 |
41 – 122 |
59 |
71 |
79 |
90 |
108 |
|
75 – 79 |
112 |
79 ± 17 |
44 – 133 |
49 |
69 |
79 |
91 |
106 |
|
80 – 84 |
73 |
76 ± 19 |
44 – 161 |
46 |
63 |
77 |
87 |
101 |
|
>85 |
33 |
70 ± 20 |
36 – 120 |
38 |
52 |
72 |
81 |
109 |
Values are given as means (SD), ranges and 5th,25th, 50th, 75th, and 95th percentile
GFR was estimated using the abbreviated formula developed for use with IDMS traceable creatinine values
Table 1b: Estimated GFR in non-diseased females of the Nijmegen Biomedical Study4
|
Age (yrs) |
N |
Mean ± SD |
Range |
P5 |
P25 |
P50 |
P75 |
P95 |
|
18 – 24 |
187 |
107 ± 21 |
64 – 257 |
82 |
92 |
105 |
118 |
136 |
|
25 – 29 |
159 |
100 ± 18 |
61 – 183 |
71 |
87 |
97 |
110 |
131 |
|
30 – 34 |
171 |
100 ± 22 |
59 – 205 |
71 |
85 |
98 |
111 |
141 |
|
35 – 39 |
193 |
93 ± 18 |
61 – 229 |
71 |
83 |
89 |
101 |
125 |
|
40 – 44 |
195 |
90 ± 16 |
53 – 147 |
66 |
77 |
90 |
100 |
122 |
|
45 – 49 |
227 |
87 ± 14 |
52 – 137 |
63 |
77 |
86 |
96 |
110 |
|
50 – 54 |
191 |
85 ± 19 |
57 – 211 |
63 |
73 |
82 |
94 |
113 |
|
55 – 59 |
174 |
82 ± 16 |
53 – 207 |
60 |
72 |
81 |
90 |
108 |
|
60 – 64 |
180 |
80 ± 17 |
45 – 204 |
56 |
70 |
79 |
88 |
101 |
|
65 – 69 |
156 |
77 ± 13 |
48 – 128 |
58 |
68 |
75 |
83 |
102 |
|
70 – 74 |
95 |
76 ± 15 |
44 – 119 |
54 |
66 |
73 |
86 |
103 |
|
75 – 79 |
77 |
71 ± 15 |
41 – 126 |
50 |
61 |
71 |
81 |
99 |
|
80 – 84 |
40 |
75 ± 20 |
51 – 149 |
51 |
63 |
72 |
86 |
108 |
|
>85 |
27 |
69 ± 18 |
33 – 107 |
39 |
54 |
71 |
81 |
94 |
Values are given as means (SD), ranges and 5th,25th, 50th, 75th, and 95th percentile
GFR was estimated using the abbreviated formula developed for use with IDMS traceable creatinine values
1. Kidney Disease: Improving Global Outcomes Glomerular Diseases Work G. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases, chapter 5 minimal change disease in adults. Kidney Int 2021;100(4S):S153-S160 https://doi.org/10.1016/j.kint.2021.05.021.
2. Maas RJ, Deegens JK, Beukhof JR, et al. The Clinical Course of Minimal Change Nephrotic Syndrome With Onset in Adulthood or Late Adolescence: A Case Series. Am J Kidney Dis 2017;69(5):637-646. DOI: 10.1053/j.ajkd.2016.10.032.
3. Chen J, Li R, Guo H, et al. Intravenous methylprednisolone for nephrotic syndrome with minimal change lesions in adults: a randomized controlled trial. Nephrol Dial Transplant 2024. DOI: 10.1093/ndt/gfae208.
4. Wetzels JF, Willems HL, den Heijer M. Age- and gender-specific reference values of estimated glomerular filtration rate in a Caucasian population: Results of the Nijmegen Biomedical Study. Kidney Int 2008;73(5):657-8. DOI: 10.1038/sj.ki.5002755.
5. Branten AJ, Vervoort G, Wetzels JF. Serum creatinine is a poor marker of GFR in nephrotic syndrome. Nephrol Dial Transplant 2005;20(4):707-11. DOI: 10.1093/ndt/gfh719.
6. Hofstra JM, Willems JL, Wetzels JF. Estimated glomerular filtration rate in the nephrotic syndrome. Nephrol Dial Transplant 2011;26(2):550-6. DOI: 10.1093/ndt/gfq443.
7. Gellermann J, Weber L, Pape L, et al. Mycophenolate mofetil versus cyclosporin A in children with frequently relapsing nephrotic syndrome. J Am Soc Nephrol 2013;24(10):1689-97. DOI: 10.1681/ASN.2012121200.
8. Kristjansson VB, Lund SH, Grondal G, et al. Increased risk of inflammatory bowel disease among patients treated with rituximab in Iceland from 2001 to 2018. Scand J Gastroenterol 2021;56(1):46-52. DOI: 10.1080/00365521.2020.1854847.
© 2022. Alle rechten voorbehouden