Terug naar het richtlijnenoverzicht
Deze multidisciplinaire richtlijn beschrijft de acute opvang en verdere behandeling van een patiënt met trombotische microangiopathie (TMA). Het snel herkennen van het ziektebeeld en de onderliggende oorzaak is van (levens)belang en het snel inzetten van behandeling is levensreddend bij TTP en kan irreversibel nierfunctieverlies bij aHUS voorkomen. Patiënten met TMA dienen derhalve te allen tijde met spoed geanalyseerd en behandeld te worden.
Verwarrend in de naamgeving is het feit dat de termen HUS en TTP beide het proces van trombotische microangiopathie beschrijven. In de richtlijn wordt derhalve de term TMA gebruikt zo lang als de exacte oorzaak nog niet bekend is.
Alle vormen van TMA hebben overlappende symptomatologie door obstructie van de microcirculatie met aggregaten van trombocyten en fibrinedraden, waardoor mechanische intravasculaire hemolyse optreedt met verbruik van bloedplaatjes en uiteindelijk orgaanschade in de organen waarin de microcirculatoire afwijkingen optreden.
De meest bekende oorzaken van TMA zijn:
Typische klinische kenmerken van TMA zijn Coombs-negatieve hemolytische anemie, trombopenie en wisselend uitval van orgaanfuncties (hersenen, nieren, hart en tractus digestivus), zodat patiënten zich bij veel verschillende specialisten kunnen presenteren.
In hoofdstuk 2.6 wordt aangegeven welk initieel laboratorium- en beeldvormend onderzoek moet worden verricht om diagnose TMA te kunnen stellen en ernst van orgaandysfunctie in kaart te brengen.
In hoofdstuk 2.7 wordt aangegeven welk aanvullend laboratorium- en beeldvormend onderzoek verricht moet worden om de oorzaak van de TMA te achterhalen met als belangrijkste adviezen:
In hoofdstuk 3 wordt uitgebreid ingegaan op de verschillende, deels zeldzame oorzaken van TMA.
In hoofdstuk 4.1 en figuur 5 wordt initiële behandeling bij verdenking TMA in afwachting van aanvullende resultaten beschreven met als belangrijkste adviezen:
Overige paragrafen van hoofdstuk 4 beschrijven de specifieke behandeling van TTP, STEC-HUS, aHUS en de secundaire vormen van TMA.
Hoofdstuk 5 beschrijft een uitgebreid protocol voor de behandeling van TTP en aanvullende/alternatieve behandeling bij recidieven of incomplete respons. Tevens worden adviezen gegeven voor anticonceptie en zwangerschap na doorgemaakte TTP.
Hoofdstuk 6 beschrijft een uitgebreid protocol voor behandeling van aHUS en aanvullende behandeling met eculizumab bij incomplete respons of recidief, gebaseerd op consensus advies van de landelijke aHUS werkgroep met vertegenwoordigers in alle academische ziekenhuizen (zie bijlage 2).
Deze landelijke aHUS werkgroep adviseert behandelaars om bij verdenking op aHUS zo vroeg mogelijk met één van hun vertegenwoordigers te overleggen over vroegtijdige inzet van eculizumab, hetgeen gezien kosten alleen in overleg met leden van landelijke aHUS werkgroepleden aanwezig in ieder academische ziekenhuis ingezet kan worden.
In dit hoofdstuk worden tevens adviezen gegeven voor anticonceptie en zwangerschap na doorgemaakte aHUS.
In de titel van de richtlijn wordt de term trombotische microangiopathie gebruikt als overkoepelende term voor een heterogene groep aandoeningen, die allemaal gekenmerkt worden door intravasculaire hemolyse, trombocytenverbruik en orgaanschade door geassocieerde microvasculaire vaatafsluiting.
Het doel van deze richtlijn is richting te geven aan differentiële diagnostiek van TMA, de therapeutische keuzes in de acute fase en de behandeling op langere termijn van TTP, aHUS, STEC-HUS en secundaire TMA.
De richtlijn is geschreven voor hematologen, hematologen in opleiding, nefrologen, nefrologen-in-opleiding, internisten met interesse in trombotische microangiopathie, kinderarts-nefrologen en kinderarts-nefrologen in opleiding, kinderarts-hematologen en kinderarts-hematologen in opleiding.
Namens subwerkgroep TTP van de NVvH (werkgroep niet-oncologische hematologie):
Namens de landelijke werkgroep aHUS:
Bijlage 2 bevat de volledige samenstelling van de landelijke werkgroep aHUS
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ondertekend waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. De belangenverklaringen zijn op te vragen bij de betrokken wetenschappelijke verenigingen. In de tabel wordt een overzicht gegeven van de richtlijn-werkgroepleden van de NVvH en hun relevante belangen.
Het probleem van de in de richtlijn omschreven heterogene groep van aandoeningen is dat zij zich meestal acuut presenteren met overlappende symptomatologie zonder specifieke kenmerken voor de achterliggende oorzaak. Een tweede probleem is dat afhankelijk van de achterliggende aandoening, de diagnostiek ter bevestiging dan wel uitsluiting van de aandoening enige uren tot zelfs weken op zich kan laten wachten. Directe (=acute) behandeling is echter vaak (zoals bijvoorbeeld in geval van TTP en aHUS) noodzakelijk. Ten aanzien van de identificerende diagnostiek en behandeling is het doel van de richtlijn om zo spoedig mogelijk te komen tot een waarschijnlijkheidsdiagnose. Het acute behandelingsadvies is gericht op de aandoeningen met de hoogste morbiditeit en mortaliteit. Het onderwerp van de onderhavige richtlijn leent zich dus slechts gedeeltelijk voor een opbouw waarbij gebruikt wordt gemaakt van zogenaamde “uitgangsvraagstellingen”. Waar mogelijk zijn uitgangsvraagstellingen geformuleerd op een zo concreet mogelijke wijze. Ook zijn door de heterogene groep aandoeningen slechts algemene uitkomstmaten zoals overleving beschreven.
De richtlijn beoogt niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan en tracht daarmee een betere uniformiteit van behandeling en daarmee een betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Het concept van deze richtlijn is voorgelegd aan de Nierpatiënten Vereniging Nederland en de Stichting Zeldzame Bloedziekten en het commentaar op deze richtlijn is verwerkt in de definitieve versie. De richtlijn wordt ter kennisgeving aangeboden aan de Vereniging van Hematologisch Laboratoriumonderzoek (VHL).
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen.
Voor de richtlijnontwikkeling en de huidige update werd literatuurstudie verricht, waarbij met name gezocht is naar studies met grote patiëntcohorten en vergelijking van verschillende behandelingen. Ten aanzien van de diagnostiek maar ook door het ontbreken van gerandomiseerde klinische studies (RCT’s) op het gebied van behandeling van de diverse (tot) TMA (leidende) aandoeningen is vaak sprake van op expert opinion beruste aanbevelingen.
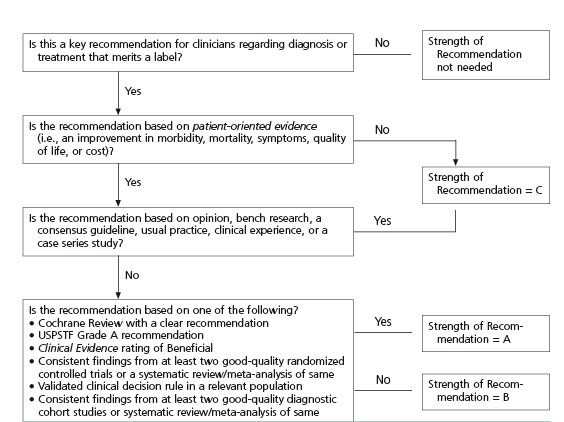
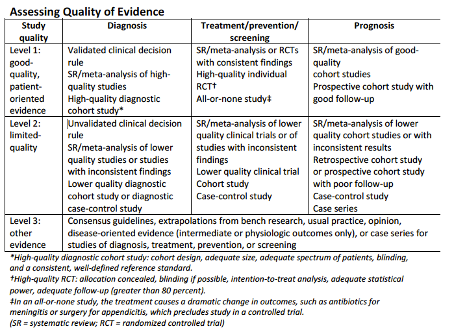
In deze richtlijn is de kwaliteit van het wetenschappelijk bewijs ten behoeve van het opstellen van ‘evidence-based’ aanbevelingen beoordeeld aan de hand van de SORT-methode. Deze methode is sterk patiënt georiënteerd (significante patiënt gerelateerde zorguitkomsten). Zie bijlage 1 voor een uitgebreide toelichting op de systematiek.
Literatuur zoekverantwoording
Referenties zijn afkomstig uit PubMed met de zoekstrategie HUS, TTP, TMA. In kader van behandeling zijn alle beschikbare gecontroleerde en gerandomiseerde klinische studies (RCTs) geïncludeerd.
Voor de pathofysiologie zijn artikelen geraadpleegd uit de verschillende vaktijdschriften.
Procedure
Na ontvangst van het commentaar van het patiëntplatform (TTP patiënten vereniging) en de aHUS kennisgroep van de Nierpatiënten-Vereniging Nederland (NVN) werd het volgende traject gestart:
Procedure herziening
Uiterlijk vijf jaar na verschijnen van deze richtlijn wordt door beide wetenschappelijke verenigingen (NVvH, NfN) beoordeeld of deze richtlijn nog actueel is. De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen het nodig maken om eerder een herzieningstraject te starten. De betrokken werkgroepen houden deze ontwikkelingen bij en overleggen jaarlijks of eerdere aanpassingen aan de richtlijn nodig zijn.
Juridische betekenis
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk en/of in het belang van een goede geïndividualiseerde zorg voor de patiënt toepasbaar is. Zo nodig [wordt gemotiveerd afgeweken van de richtlijn].
Het is de verantwoordelijkheid van de individuele behandelaar de inhoud van deze richtlijn te implementeren in de dagelijkse klinische praktijk. Om het gebruik echter in de dagelijkse praktijk te bevorderen wordt deze richtlijn verspreid onder de professionals van de bij de totstandkoming van deze richtlijn betrokken organisatie(s):
TTP patiënten vereniging (Stichting Zeldzame Bloedziekten): Dhr L. Neijenhuis
Nierpatiënten-Vereniging Nederland (NVN): Mw. Marjolein Storm
In de afgelopen jaren heeft de behandeling van verworven TTP een vogelvlucht genomen met de introductie van caplacizumab en de intensivering van immuunmodulatoire behandeling.
Deze huidige versie van de richtlijn borduurt voort op nieuwe inzichten verkregen uit eigen en internationale ervaringen rondom de behandeling van TTP met deze middelen. Een belangrijke aanpassing in de huidige richtlijn betreft de aanbeveling om rituximab te incorporeren in de eerstelijnsbehandeling van TTP, dus upfront vanaf het moment van stellen van diagnose. Deze aanbevelingen zijn opgenomen in hoofdstuk 5 van de huidige richtlijn waar de initiële behandeling van TTP en behandeling van het recidief worden beschreven.
De huidige richtlijn blijft daarmee gebaseerd op internationale richtlijnen voor de behandeling en diagnose van TTP en atypische HUS (aHUS).1-10
Alle vormen van trombotische microangiopathie hebben overlappende symptomatologie die optreedt door obstructie van de microcirculatie met aggregaten van trombocyten en fibrinedraden. Hierdoor treedt mechanische intravasculaire hemolyse op en worden trombocyten verbruikt, waardoor uiteindelijk orgaanschade optreedt in de organen waarin de microcirculatoire afwijkingen optreden (Figuur 1).2
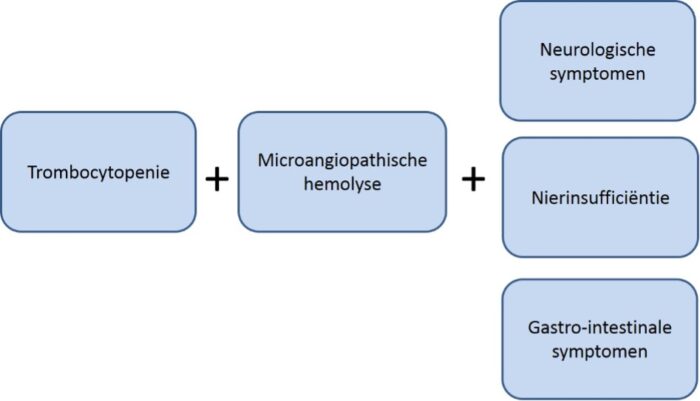
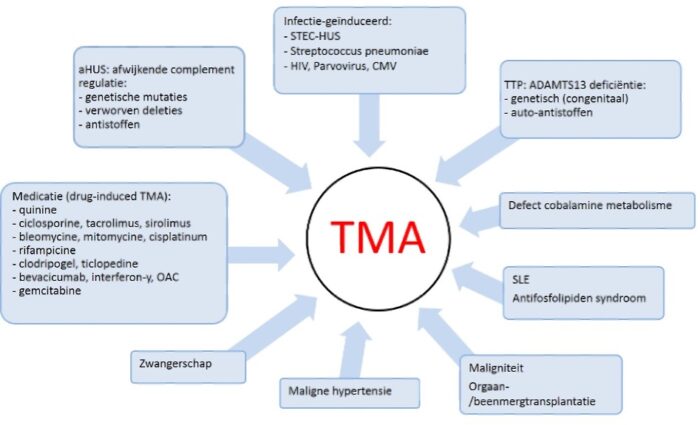
Er zijn diverse oorzaken van TMA bekend. Het klinisch beeld overlapt gedeeltelijk, maar soms is op grond van de voorgeschiedenis of bepaalde ziekteverschijnselen wel een oorzaak voor de TMA waarschijnlijk (Figuur 2). De meest bekende oorzaken zijn:
Verwarrend in de naamgeving is het feit dat de termen HUS en TTP beide het proces van trombotische microangiopathie beschrijven. Aan deze termen kan men dan ook niet de onderliggende oorzaak herkennen. Het is een kwestie van afspraak welke oorzaak-met-ziektebeeld met welk acronym wordt aangeduid. Wij pleiten ervoor om de term TMA te gebruiken zo lang de oorzaak van de TMA niet is vastgesteld.
Klinische symptomen zijn sterk afhankelijk van de oorzaak en de ernst van de intravasculaire hemolyse en de mate van betrokkenheid van de verschillende organen:
|
WHO bloedingsgraad |
Bloedingskenmerken |
|
Graad 0 |
Geen bloeding. |
|
Graad 1 |
Niet confluerende petechiën/purpura. |
|
Graad 2 |
Milde, klinisch relevante bloeding zonder noodzaak tot transfusie en zonder hemodynamische instabiliteit. |
|
Graad 3 |
Ernstige bloeding zonder hemodynamische instabiliteit waarvoor noodzaak bloedtransfusie en/of inwendige bloeding en/of cerebrale/retinale bloeding zonder neurologische uitval. |
|
Graad 4 |
Zeer ernstig bloeding met hemodynamische instabiliteit en/of cerebrale/retinale bloeding met neurologische uitval. |
Het initiële laboratoriumonderzoek bij het ziektebeeld van TMA wordt gekenmerkt door:
Deze afwijkingen bij het laboratoriumonderzoek variëren in ernst tussen de verschillende oorzaken en klinische beelden van TMA. Ze kunnen echter niet betrouwbaar differentiëren tussen de verschillende oorzaken. Let op: positieve DAT (directe antiglobuline test) wordt gezien bij Streptococcus pneumoniae – HUS.
Het volgende onderzoek moet bij verdenking op TMA aanvullend direct worden ingezet:
Acute TTP betreft meestal jonge vrouwelijke (vrouw:man 8:2) patiënten met diepe trombopenie (<20-30 x 109/L trombocyten) en symptomen, die vaak aan de hemolyse voorafgaan:
Zonder behandeling loopt acute TTP in 90% van de gevallen dodelijk af. Door tijdige diagnose kan deze levensbedreigende aandoening momenteel bij 85% van de patiënten met succes worden behandeld.17 Het betreft een zeldzame aandoening.
Er bestaan meerdere diagnostische scores om de waarschijnlijkheid van de diagnose TTP in te schatten in afwachting van de uitslag van ADAMTS13 activiteit. De gevalideerde PLASMIC score geeft bij een score van 6 of 7 een waarschijnlijkheid op TTP van 60-80% versus 10-25% bij een score van 5 of lager.15 Elk van onderstaande items levert 1 punt op.
|
Trombocyten <30×10^9/L |
Geen VG solide of hematopoietische (stamcel)transplantatie |
INR <1.5 |
|
Aanwezigheid hemolyse |
MCV <90 gl |
Kreatinine <177 umol/L |
|
Afwezigheid actieve maligniteit |
|
|
PLASMIC score: aanwezigheid hemolyse = reticulocyten >2.5% en/of onderdrukt haptoglobine en/of indirecte bilirubine >34 µmol/L.
Acute TTP ontstaat bij vrijwel alle patiënten door een verminderde activiteit van het enzym dat von Willebrand Factor afbreekt tot kleinere eenheden, het protease ADAMTS13.17-19
STEC-HUS is de meest voorkomende vorm van HUS (90%) en komt het meest voor op de kinderleeftijd:
Recent zijn er ook epidemieën bij volwassenen geweest met ernstige nierinsufficiëntie.
Op tijd stellen van de diagnose is cruciaal voor het beloop zodat adequate symptomatische behandeling waaronder nierfunctievervangende therapie (70%) tijdig gestart wordt. Mortaliteit in de acute fase bedraagt 2-5%. De morbiditeit op de lange termijn bedraagt 20-30% (hypertensie, proteïnurie, chronische nierinsufficiëntie) en 2-3% zal later eindstadium nierfalen ontwikkelen.1
De meest voorkomende oorzaak is een gastro-intestinale infectie met Shigatoxine producerende Coli (STEC), in het merendeel met het serotype O157:H7.
De diagnose wordt gesteld door positieve feceskweken en/of positieve fecale PCR Shigatoxinen en/of positieve serologie van antistoffen tegen O-antigeen3 (voor richtlijn diagnostiek: rivm.nl). De detectiekans voor een positieve feceskweek bij STEC-HUS patiënt bedraagt 30%. Dit komt omdat een klein bacteriële load reeds voldoende is om ziek te worden en ten tijde van de diagnostiek bij opname, vaak 3-5 dagen na start diarree, de detectiekans sterk is afgenomen. PCR tegen Shigatoxinen laat de detectiekans tot 50% stijgen. In vergelijking met feceskweken is de serologie vaker positief dan de kweek/PCR. Deze antistoffen tegen O157 of andere O serotypes zijn na de infectie langer detecteerbaar dan de bacterie in de feces. Advies is om meerdere fecale kweken, dan wel rectal swabs indien geen feces beschikbaar, in te zetten (3 opeenvolgende fecesmonsters) en serologie tegen O-antigeen af te nemen (zie paragraaf 3.7).
STEC-infectie is een meldingsplichtige infectie (GGD/RIVM).
HUS veroorzaakt door een infectie met Streptococcus pneumoniae (SP) wordt met name gezien op de kinderleeftijd, maar kan ook bij ouderen voorkomen en is zeldzaam.22
Bij de pathofysiologie speelt neuraminidase geproduceerd door deze bacterie een belangrijke rol. De door neuraminidase geknipte siaalzuren aan oppervlakte van endotheel, trombocyten en erythrocyten maken dat het cryptische Thomsen Friedreich antigeen (T-antigeen) tot expressie komt, wat reageert met reeds aanwezige antilichamen in de circulatie.
De diagnose is niet altijd eenvoudig te stellen gezien de overeenkomsten met de kliniek van disseminerende intravasculaire stolling (DIC).
Naast de klassieke trias van HUS wordt hier juist een positieve directe Coombs gevonden (detectie van T-antigeen-antilichaam interactie in plasma, 90% positief).23
Bewijzend voor een SP-HUS is het aantonen van de bacterie in bloed en/of liquor, maar deze kweken zijn ondanks kliniek vaak negatief. Een urinetest op S. Pneumoniae antigeen kan bijdragend zijn.
Een andere methode is het indirect aantonen van neuraminidase activiteit middels een transferrine isoelectric focussing assay, alwaar het glycosyleringspatroon van transferrine een kenmerkend patroon vertoont.24
Bij de eerste presentatie is de kliniek vaak niet altijd even duidelijk:4, 7, 24
Bij een klein deel van de patiënten wordt een subklinisch beloop van weken tot maanden gezien:
Vaak wordt er een uitlokkende factor beschreven zoals bovenste luchtweginfectie of gastro-intestinale infectie, vaccinatie en zwangerschap.
Ook aHUS kent extrarenale symptomen in de acute fase:
aHUS kent familiaire (15-20%) alsmede sporadische vormen en kan recidiveren. Eerste manifestaties kunnen op alle leeftijden optreden, ook bij genetische oorzaken (bijvoorbeeld in zwangerschap).
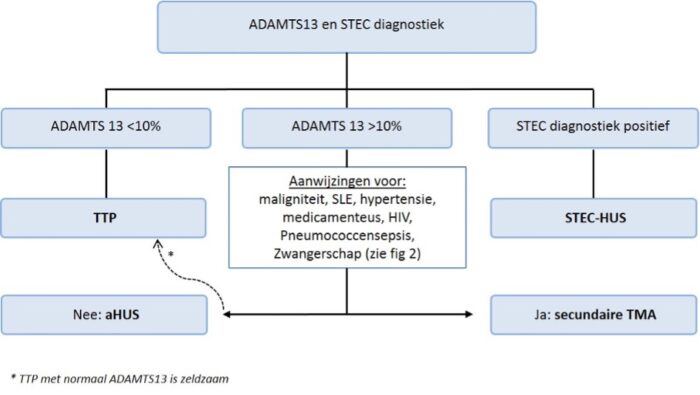
De diagnose aHUS wordt gesteld indien er geen andere oorzaken voor HUS aanwezig zijn, dat wil zeggen geen STEC infectie, ADAMTS13 activiteit ≥10% en geen andere onderliggende oorzaken van secundaire TMA zoals zwangerschap, medicijngebruik of hypertensieve crises.2, 7
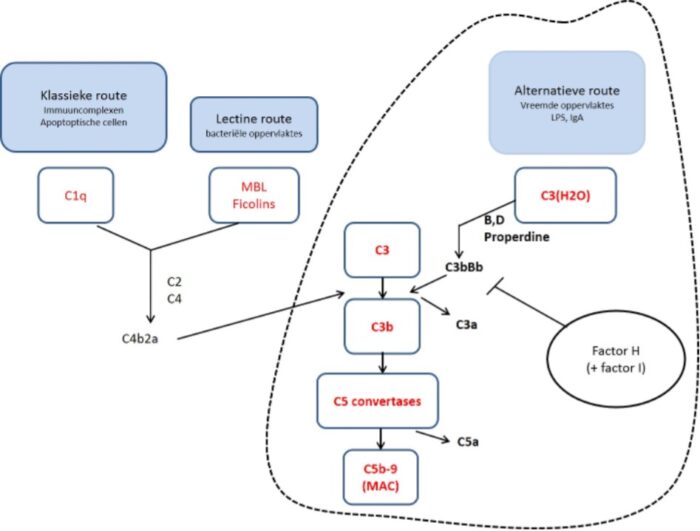
Verlaagd complement C3 kan een aanwijzing zijn voor aHUS, maar wordt lang niet bij alle patiënten beschreven. Een normaal serum C3 sluit de diagnose aHUS derhalve niet uit. Het meten van de complement eiwitten C3/C4 wordt wel ingezet, maar heeft geen discriminerende functie in de differentiaal diagnose. Een verlaagd C3 kan wel een aanwijzing zijn voor aHUS. Een verhoogd complement activatie product C3d kan wijzen op een verhoogde activatie van de alternatieve route van het complement systeem.
Het pathofysiologisch mechanisme is ondertussen steeds duidelijker: aHUS ontstaat ten gevolge van een ongecontroleerde activatie van de alternatieve route van het complement systeem (zie figuur 4).
Dit alles maakt dat men tegenwoordig spreekt over een genetisch complement profiel, zogenaamd complementtype met een verhoogde vatbaarheid voor aHUS.
Genetische analyse van complementgenen alsmede aantonen van de aanwezigheid van antistoffen tegen factor H wordt gedaan in het Radboudumc te Nijmegen: aHUS Radboud
en door Sanquin te Amsterdam: (genoom), Immunodiagnostiek formulier
Alle patiënten met aHUS dienen hierop getest te worden, mede omdat de genetische achtergrond belangrijk is voor het inschatten van de prognose en het risico op recidief na niertransplantatie. Genetische analyse is ook nodig met het oog op donorselectie.
Meerdere medicamenten kunnen TMA veroorzaken, waarbij de diagnose moeilijk kan zijn door ontbreken van specifieke testen om aan te tonen dat het desbetreffende geneesmiddel verantwoordelijk is voor de TMA.11 Om de diagnose aannemelijk te maken dienen andere vormen van TMA uitgesloten te worden (diagnose per exclusionem).
Bij verdenking op DITMA dient het verdachte geneesmiddel uiteraard gestaakt te worden, maar door overlap van het klinische beeld met andere vormen van TMA kan het erg moeilijk zijn om het optimale beleid te bepalen.
Indien relatie tussen geneesmiddel en TMA onduidelijk is, kan een poging gedaan worden om geneesmiddel-afhankelijke antilichamen aan te tonen (zeker bij ‘levensreddende’ geneesmiddelen). In de USA zijn er mogelijkheden om dit te testen in Blood Center of Wisconsin:
https://www.versiti.org/medical-professionals/products-services/diagnostic-labs
Bij onvoldoende respons op staken van medicatie moet alternatieve diagnose van aHUS opnieuw overwogen worden.
Er kan onderscheid gemaakt worden tussen:
Bij onderstaande middelen moet in ieder geval DITMA overwogen worden, maar deze lijst is zeker niet compleet. Voor een uitgebreider overzicht en complete lijst met medicatie wordt verwezen naar:
Antilichaam gemedieerde DITMA:
Toxisch gemedieerde DITMA
Clopidrogel en ticlopidine geassocieerde DITMA/TTP
TMA die voorkomt bij maligne hypertensie, antifosfolipiden syndroom, scleroderma, sepsis, CMV, HIV, parvovirus, maligniteit, stamceltransplantatie en zwangerschap (HELLP, pre-ecclampsie), diepe vitamine B12 deficiëntie onderscheidt zich door de anamnese, gegevens bij lichamelijk onderzoek, aanvullend onderzoek en onderliggende ziekte.12, 33
DGKE (diacylglycerol kinase epsilon) mutatie
Cobalamine C deficiëntie
Bij verdenking van TMA is het belangrijk om in afwachting van specifieke testen direct met behandeling in de vorm van plasmawisselingen te starten tenzij er sprake is van:
Aangezien plasmawisselingen (plasmaferese/plasmafiltratie) levensreddend zijn bij TTP en irreversibel nierfunctieverlies bij aHUS kunnen voorkomen, dient deze behandeling in de meeste gevallen zo spoedig mogelijk gestart te worden (na afname van bloed voor ADAMTS13 activiteit). Het moment van start wordt mede gedicteerd door de ernst van de trombocytopenie en de ernst van het (neurologische) klinisch beeld.
Dit geldt ook voor TMA in de zwangerschap, met name bij ernstige trombopenie, neurologische symptomen of acute nierinsufficiëntie met TMA zonder andere tekenen van HELPP, omdat HELLP en pre-eclampsie qua symptomatologie met TTP of aHUS kunnen overlappen.12
In de praktijk wordt TTP in de meeste centra behandeld door de hematoloog en alle andere vormen van TMA die gepaard gaan met nierfunctiestoornissen (aHUS, STEC-HUS) door de nefroloog, waarbij goede samenwerking noodzakelijk is gezien overlap tussen klinische beelden.
De plasmawisselingen kunnen plaatsvinden met centrifugetechniek (plasmaferese met citraat, meestal onder verantwoordelijkheid van de hematoloog) of met filtratietechniek (plasmafiltratie met heparine of citraat, meestal onder verantwoordelijkheid van de (kinder)nefroloog). De gepubliceerde klinische studies met eindpunt mortaliteit zijn vaak onduidelijk of plasmaferese of plasmafiltratie is toegepast. Plasmaferese (met citraat) heeft het voordeel dat er geen heparine nodig is. Indien (acute) behandeling alleen met plasmafiltratie uitgevoerd kan worden, zal dit bij ernstige trombopenie uitgevoerd moeten worden zonder heparine of met citraat antistolling.
Bij plasmawisselingen kunnen zo nodig prednison i.v. en anti-histaminica gegeven worden ter profylaxe van (allergische) reacties op plasma.
Bij sterke verdenking op aHUS kan met name bij kinderen de voorkeur worden gegeven aan direct starten van behandeling met eculizumab. Zie paragraaf 4.6 en hoofdstuk 6.
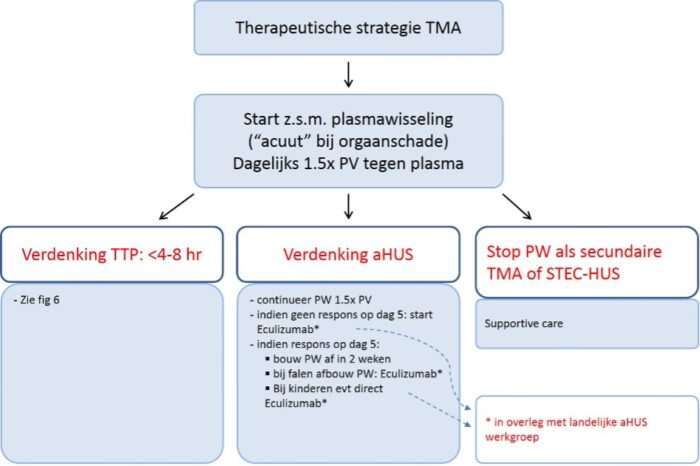
Figuur 5. Initiële behandeling bij TMA.
PV = plasmavolume. PW = plasmawisseling.
Bij STEC-HUS is er geen plaats voor plasmawisseling (plasmaferese/plasmafiltratie; SORT level B).39
Behandeling dient te bestaan uit adequate supportive care, goede vocht- en mineralen huishouding, bloeddrukregulatie, nierfunctievervangende therapie en zo nodig bloedtransfusies. Gezien het risico op exacerbatie dient men zeer terughoudend te zijn met trombocytentransfusies.
De STEC infectie dient in principe níet met antibiotica behandeld te worden aangezien er aanwijzingen zijn dat vroege behandeling van een STEC infectie met sulfa bevattende en beta-lactam antibiotica de kans op ontwikkeling van HUS juist verhogen door inductie van een precursor faag met het shigatoxine gen en vervolgens toename van release van shigatoxine uit dode bacteriën.40, 41 Ook het gebruik van fluoroquinolonen is controversieel omdat deze middelen in vitro shigatoxine fagen kunnen induceren en in vivo in dierstudies zowel lagere als hogere kans op ontwikkeling van HUS hebben laten zien. Enkele kleine klinische studies met fluoroquinolonen hebben echter géén of lagere kans op ontwikkeling van HUS laten zien. Subinhibitoire concentraties van gentamycine, meropenem en azitromycine lieten in vitro geen toename van shigatoxine productie zien en azitromycine liet daarbij door remming van RNA-afhankelijke eiwitsynthese de laagste shigatoxine productie zien. Gezien deze gunstige resultaten loopt er momenteel in Frankrijk een RCT met azitromycine behandeling van diarree geassocieerde HUS. Gezien al deze gegevens zou het wellicht verstandig zijn om bij keuze van antibiotica voor andere infecties dan de STEC hiermee rekening te houden.42
Bij STEC-HUS is er geen bewijs voor het gebruik van eculizumab (SORT level B).6
Bij verdenking op DITMA dient het verdachte geneesmiddel uiteraard gestaakt te worden en is er in principe geen plaats voor behandeling met plasmawisseling (SORT level B),39 maar door overlap van het klinische beeld met andere vormen van TMA kan het erg moeilijk zijn om het optimale beleid te bepalen door onzekerheid over de diagnose.
Vooral bij antistof gemedieerde vormen van DITMA (zie 3.5) zal het in afwachting van verdere onderzoeken vaak noodzakelijk zijn om patiënt (tijdelijk) met plasmawisselingen te behandelen. Antistoffen zullen geleidelijk verdwijnen als het verantwoordelijke medicijn niet meer gegeven wordt.
Bij een TMA beeld tijdens gebruik van ADP/P2Y12 receptor blokkers zoals clopidogrel dient ADAMTS13 activiteit zo spoedig mogelijk bepaald te worden en bij verlaagde activiteit dient patiënt behandeld te worden zoals bij TTP gebruikelijk is (SORT level C).35
Bij TMA geassocieerd met een onderliggende ziekte of zwangerschap moet over het algemeen de onderliggende oorzaak/aandoening worden behandeld (SORT level B).2, 8 Plasmawisseling heeft hierbij geen plaats behoudens bij HIV met beeld van TTP en mogelijk bij het catastrofaal antifosfolipiden syndroom:
Gezien de complexiteit van de behandeling is een landelijke werkgroep aHUS opgericht met in ieder UMC een vertegenwoordigende nefroloog en kindernefroloog (zie bijlage 1). Het verdient aanbeveling om bij iedere patiënt met vermoedelijke aHUS in een zo vroeg mogelijk stadium met één van de leden van deze werkgroep te overleggen.
Bij verdenking op aHUS dient diagnostiek ter uitsluiting van andere oorzaken van HUS/TMA zo spoedig mogelijk te worden ingezet (in ieder geval ADAMTS13 en diagnostiek naar STEC-HUS).
Omdat de uitslagen niet meteen beschikbaar zullen zijn, wordt zo spoedig mogelijk gestart met bij voorkeur dagelijkse plasmaferese/plasmafiltratie (zie 4.1 en figuur 5; SORT level B).7
Bij kinderen kan overwogen worden om in overleg met de landelijke werkgroep aHUS (zie bijlage 1) direct te starten met eculizumab.
Indien er na 4 sessies plasmawisseling geen verbetering optreedt (duidelijke stijging van aantal trombocyten en daling van LDH) bij normale ADAMTS13 activiteit (≥10%) en afwezigheid van STEC/EHEC-infectie, dient overlegd te worden met een lid van de landelijke werkgroep aHUS van één van de UMC’s (zie bijlage 1) voor overplaatsing van patiënt voor behandeling met eculizumab (een remmer van het terminale complement complex) conform de richtlijn aHUS (zie figuur 7 en hoofdstuk 6).45
Bij behandeling met eculizumab is vaccinatie tegen Neisseria meningococcae bacterie een vereiste (zie hoofdstuk 6.4).
In de eerste 2 weken van behandeling met eculizumab is antibiotische profylaxe tegen meningococcen infectie noodzakelijk.
Tijdens eculizumab behandeling dient te allen tijde onverwijld medische evaluatie plaats te vinden bij koorts, hoofdpijn of andere klachten die kunnen passen bij meningitis.
Bij bekende patiënten met aHUS en afwijkingen in het complement systeem moet bij een aanval afhankelijk van eerdere beloop zo nodig direct eculizumab worden ingezet.
Naast plasmawisselingen en eculizumab moet ook gezorgd worden voor agressieve bloeddrukbehandeling (tot < 130/80 mm Hg) en dient eventueel luxerende medicatie direct gestaakt te worden.
Gezien acute noodsituatie met vaak snel verergerende orgaanschade dient plasmawisseling zo spoedig mogelijk gestart te worden en dient niet gewacht te worden op de uitslag van ADAMTS13 activiteit als bevestiging van de diagnose. Kwaliteitseis voor het als centrum behandelen van TTP is dat te allen tijde (dag, nacht weekend) plasmawisseling kan starten uiterlijk 4-6 uur na (verdenking op) de diagnose TTP (kwaliteitseis I). Daarnaast dient een TTP behandelcentrum te allen tijde opvang en snelle start van behandeling te kunnen regelen voor een TTP patiënt uit de verwijzende ziekenhuizen (kwaliteitseis II). Tevens moet gewaarborgd zijn dat de ADAMTS13 uitslag binnen 48 uur bekend is (kwaliteitseis III).
Niet alle centra in NL beschikken over 24/7 plasmaferese faciliteiten. In geval plasmawisseling niet per direct mogelijk is, dient ingeschat te worden of overbrugging mogelijk is middels toediening van (minimaal 2-3 eenheden) plasma of dat patiënt zo snel mogelijk overgeplaatst wordt naar een TTP behandelcentrum met 24/7 plasmaferese mogelijkheid. Plasmafiltratie kan in deze situatie overwogen worden als alternatief voor een eerste plasmaferese. Indien vervoer niet mogelijk is: overleg met TTP behandelcentrum over alternatieven.
Een systematische review uit 2007 heeft laten zien dat plasmawisseling ten opzichte van plasmainfusie effectiever is.17
|
Respons |
Voorwaarden |
|
Hematologische complete respons (vanaf dag 7), hCR |
|
|
Immunologische respons, iCR |
|
|
Hematologische remissie |
|
|
Immunologische remissie |
|
|
Hematologisch recidief |
|
|
Immunologisch recidief |
|
|
Geen respons |
en/of
|
|
Progressieve ziekte |
|
Definities gebaseerd op Cuker et al, Blood 2021,46 met als aanpassing de afwezigheid in onderscheid tussen een exacerbatie (‘vroeg recidief’, namelijk <4 weken na laatste plasmaferese en anti-VWF therapie) en recidief (>4 weken na laatste plasmaferese en anti-VWF therapie).
De initiële behandeling van verworven TTP bestaat uit:
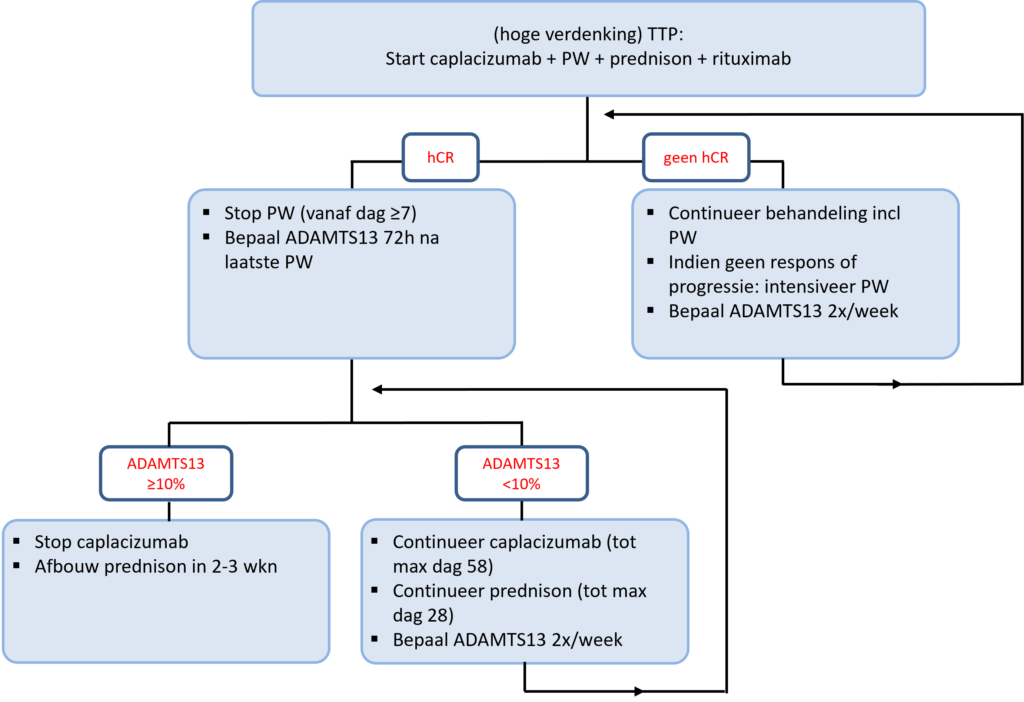
Figuur 6 illustreert schematisch het behandelschema van verworven TTP.
Plasmawisseling
In geval van neurologische symptomen, orgaanischemie en bedreigde zwangerschap is plasmawisseling levensreddend en dient dit onmiddellijk gestart te worden (SORT level A). Ook bij twijfel over de diagnose dient patiënt zo snel mogelijk behandeld te worden als TTP met plasmawisseling.
In een systematische review is aangetoond dat plasmawisseling superieur is ten opzichte van plasma-infusie (relatieve risico 0.31, 95% betrouwbaarheidsinterval 0.12–0.79) (SORT level A). 16
Indien plasmawisseling echter niet (direct) beschikbaar is: infundeer 2-3 EH plasma en plaats patiënt zo snel mogelijk over naar een centrum met plasmaferese mogelijkheid en beschikbaarheid caplacizumab (zie bijlage 4). Plasmafiltratie kan overwogen worden als alternatief voor een eerste plasmaferese indien niet direct beschikbaar.
Plasmavolume:
Duur plasmawisseling:
Techniek: Plasmawisseling kan gebeuren in de vorm van plasmaferese (centrifugetechniek) of plasmafiltratie (dialysetechniek) aangezien beide technieken even effectief lijken te zijn in het verwijderen van hoog multimeer von Willebrand factor, zoals aangetoond in een kleine Nederlandse studie.50 Bij de gepubliceerde klinische studies met eindpunt mortaliteit is vaak onduidelijk of plasmaferese of plasmafiltratie is toegepast. Plasmaferese heeft als voordeel dat er geen heparine nodig is. Indien (acute) behandeling alleen met plasmafiltratie uitgevoerd kan worden, zal dit gezien de meestal ernstige trombopenie uitgevoerd moeten worden zónder heparine (citraat antistolling als vervanger). Bovendien zal dagelijkse plasmawisseling bij voorkeur pas gestopt worden wanneer een alternatieve diagnose (zeer) waarschijnlijk is.
Infusietoegang: Bij voorkeur wordt de centraal veneuze catheter geplaatst vooraf aan de eerste gift caplacizumab óf vindt plasmaferese plaats middels perifere veneuze toegang. Het eerste kan echter in de praktijk leiden tot vertraging in toediening van een eerste dosis caplacizumab. Derhalve kan het zijn dat, zeker bij een fulminante trombo-ischemische presentatie van TTP, het (theoretisch) bloedingsrisico van CVC plaatsing na reeds een gift caplacizumab geaccepteerd moet worden.
Caplacizumab
Caplacizumab is een gehumaniseerd nanobody dat bindt aan het A1-domein van het von Willebrand factor (VWF) eiwit. Door deze binding wordt de interactie van VWF met het glycoproteine Ib-IX-V op de trombocyt voorkomen waardoor het micro-angiopathische proces een halt wordt toegeroepen. Op deze manier dient het middel ter overbrugging tot intreden van immunologisch effect van prednison en eventueel andere immunosuppressieve middelen (SORT level B). Belangrijkste bijwerking inherent aan dit mechanisme is het optreden van bloedingen. Het middel is derhalve (relatief) gecontra-indiceerd bij een TTP gepaard gaande met levensbedreigende bloedingen (WHO graad 3-4).
Behandeling met caplacizumab tot maximaal 58 dagen na laatste plasmaferese is veilig en effectief gebleken in de eerste lijnsbehandeling van TTP.51-56 De voor plasmaferese benodigde hoeveelheid plasma neemt met meer dan 30% af, responsen treden sneller op met reductie van exacerbaties en de ziekenhuis- en opnameduur wordt verkort. Wel is de kans op een recidief TTP in de periode na staken van het middel groter indien geen immunologische complete respons (=ADAMTS13 activiteit ≥10%) is bereikt. De werkgroep is van mening dat calpacizumab als initiële behandeling aan de standaardbehandeling van plasmawisseling en corticosteroïden bij alle patiënten dient te worden toegevoegd.
Indicatie: sterke verdenking op of reeds bewezen TTP (ADAMTS13 activiteit <10%). Bij gerede twijfel over de diagnose TTP én afwezigheid van orgaanischemie wordt behandeling met prednison en plasmaferese opgestart in afwachting van de ADAMTS13 activiteit. Indien ADAMTS13 activiteit <10% blijkt wordt alsnog caplacizumab aan de behandeling toevoegen.
Behoudens enkele case reports zijn er geen gegevens over veiligheid van caplacizumab tijdens de zwangerschap en tijdens het geven van borstvoeding.57, 58
Dosis:
Duur: deze is afhankelijk van het moment van bereiken van een immunologische respons (=ADAMTS13 activiteit ≥10%). Zodra bereikt, wordt caplacizumab gestaakt.59 De behandelduur wordt uiterlijk 58 dagen gecontinueerd, ook indien nog geen immunologische respons is bereikt. Indien echter op dag 58 ook nog geen hematologische respons is bereikt, overweeg continueren en intensiveer waar mogelijk immunosuppressieve behandeling. Overleg in deze situatie altijd met de TTP werkgroep over vervolg van behandeling (bij voorkeur middels privacy-veilige TTP siilo app). Alle TTP behandelcentra zijn via een afgevaardigde vertegenwoordigd in de landelijke TTP werkgroep en hebben toegang tot deze app (kwaliteitseis VI; zie voor centra bijlage 4).
Toetsing gebruik: Behandeling met caplacizumab dient altijd overlegd te worden met en getoetst te worden door de TTP werkgroep (middels privacy-veilige TTP siilo app). Indien overleg vóóraf aan start niet mogelijk is (nacht, weekend, zeer spoedeisende situatie) dient dit uiterlijk de eerstvolgende werkdag plaats te vinden (kwaliteitseis V).
Caplacizumab bij kinderen <18 jaar
Er zijn beperkte data over de behandeling met caplacizumab bij kinderen met verworven TTP; de inclusieleeftijd in de gepubliceerde fase 2 en fase 3 trials was vanaf 18 jaar.51, 53 Het gebruik van caplacizumab bij kinderen met TTP is beschreven in meerdere case reports .55, 60-63 De behandeling met caplacizumab bij verworven TTP bij kinderen vanaf 12 jaar met een lichaamsgewicht boven de 40 kg is gebaseerd op een farmacokinetisch-farmacodynamisch populatiemodel en goedgekeurd door de EMA. Behandeling met caplacizumab dient altijd getoetst te worden door de TTP werkgroep (middels privacy-veilige TTP siilo app).
Er zijn nog minder data omtrent gebruik van caplacizumab in de behandeling van verworven TTP bij kinderen <12 jaar en met een lichaamsgewicht <40 kg. Volgens een vervolgstudie op bovengenoemd simulatiemodel induceert een dosis van 5 mg bij kinderen >2 jaar en <40 kg een caplacizumab exposure en suppressie van vWF:Ag levels vergelijkbaar met levels in volwassenen.64 Het is wenselijk om contact op te nemen met de TTP werkgroep hoe caplacizumab voor deze leeftijdsgroep kan worden ingezet bij de behandeling.
Prednison
Startdosis is prednison 1 mg/kg. In geval van immunologische respons (ADAMTS13 activiteit >10%) dosis afbouwen in 2-3 weken. Indien na 4 weken nog geen iCR is bereikt, ook dan prednison afbouwen tot 0 mg en start alternatieve medicatie na 4 giften rituximab (zie 5.4).
Indien gestart is met methylprednisolon 1 gram 1dd gedurende 3 dagen, hierna vervolgen met oraal prednison 1 mg/kg met duur en afbouwschema zoals hierboven.
In geval van gerede twijfel aan de diagnose TTP en belangrijke contra-indicaties (infecties) kan start van corticosteroïden worden uitgesteld totdat de diagnose TTP zeer waarschijnlijk is (bevestiging van ADAMTS13 activiteit <10%).9, 17
Rituximab
De plaats van rituximab schuift in deze richtlijnversie op naar de eerstelijns behandeling, gericht op het bespoedigen van een immunologische respons. Het middel wordt per maart 2025 ook voor dit indicatiegebied vergoed.
Start na confirmatie van diagnose TTP (ADAMTS13 activiteit <10%) rituximab 375 mg/m2, totaal 4 giften 2x/week (dag 1,4,8,11).
Rituximab doseringen die vallen in de periode waarin ook plasmaferese plaatsvindt dienen direct aansluitend aan de plasmawisseling toegediend te worden om de klaring te beperken. Alhoewel het doseringsinterval van rituximab geen effect heeft op de snelheid van bereiken en diepte van B-cel depletie en de klinische meerwaarde onbekend is, wordt met een 2x/week schema in vergelijking met wekelijkse toedieningen sneller adequate dalspiegels van rituximab bereikt met theoretisch geredeneerd dan ook een versneld bereiken van immunologische respons.65 Het is niet erg aannemelijk dat de beperkte klaring van rituximab middels plasmaferese een negatief effect heeft op bereiken van immunologische respons, o.a. gezien lagere doseringen rituximab ook effectief lijken in TTP en perifere B-cel depletie wel adequaat optreedt met rituximab tijdens plasmawisseling.65, 66
Overige maatregelen:
Met de introductie van caplacizumab is er geen indicatie voor aspirine of andere trombocyten aggregatieremmers bij cardiale ischemie/CVA.
Foliumzuur 1dd 5 mg tot het bereiken van een complete hematologische respons.
Protonpompremmer tijdens de volledige behandeling met prednison, inclusief afbouwen.
Erytrocytentransfusie bij symptomatische anemie (Zie CBO Bloedtransfusie richtlijn 2020).
Trombocytenconcentraat alleen bij levensbedreigende bloedingen (WHO graad 3-4) en niet preventief bij ingrepen of bloedingen WHO graad 1-2. Gezien de pathofysiologie van TTP is terughoudendheid met trombocytentransfusie gewenst. De negatieve invloed van trombocytentransfusie bij TTP is echter onzeker (SORT level C).47
Er is geen plaats voor plasma-infusie als onderhoud/tapering (SORT level B).8
Vanaf dag 7 wordt zowel de hematologische als immunologische respons beoordeeld.
Indien hematologische complete respons wordt plasmawisseling gestaakt. 72 uur na de laatste plasmawisseling wordt ADAMTS13 activiteit bepaald (NB dit interval dient ter voorkoming van een foutief-normaal resultaat voor ADAMTS13 activiteit als gevolg van ADAMTS13 substitutie terwijl nog wel actieve TMA). Indien sprake is van een immunologische complete respons (ADAMTS13 activiteit ≥10%) wordt caplacizumab gestaakt en gestart met afbouw prednison tot 0 mg in 2-3 weken. Indien geen sprake is van een immunologische complete respons worden caplacizumab en prednison gecontinueerd (SORT level B). ADAMTS13 activiteit wordt 2x/week bepaald tot een immunologische complete respons bereikt is, waarbij gehandeld wordt zoals hierboven beschreven.
In geval van geen respons of progressieve ziekte kan overwogen worden om de plasmawisselingen te intensiveren (2dd à 1.0 plasmavolume).
Men dient zich te realiseren dat het bereiken van een hematologische respons onder het gebruik van caplacizumab geen betekenis meer heeft ten aanzien van immunologische ziektecontrole. Het bereiken van een immunologische respons, welke beoordeeld wordt aan de hand van de ADAMTS13 activiteit, is de cruciale doelstelling van de behandeling geworden.
Bovenstaande is schematisch weergegeven in figuur 6 en per type respons samengevat in onderstaande tabel.
|
Evaluatie vanaf dag 7, respons |
Beleid |
|
Hematologische complete respons (minimaal 2 dagen achtereen) |
|
|
Geen hematologische complete respons of progressieve ziekte |
|
Evaluatie en vervolgbeleid nadien:
Wanneer na 4 weken prednison 1 mg/kg nog geen complete immunologische respons is bereikt, wordt op basis van steroïd-refractairiteit prednison afgebouwd tot 0 mg (SORT level C).
Indien op dag 30 na de plasmaferese (en 4 giften rituximab) nog geen immunologische respons is bereikt, dient 3e lijnsbehandeling met immunosuppressiva sterk overwogen te worden. Overweeg hiervoor:
Overleg in deze situatie laagdrempelig met de TTP werkgroep over timing en keuze van behandeling (middels privacy-veilige TTP siilo app).
Milde klinische presentatie zonder neurologische/cardiale symptomen met trombocyten >80 x 109/L
Bij trombocyten <80 x 109/L
Bij ≥2 recidieven
Persisterende aanwezigheid van ADAMTS13 antistoffen in remissie en/of persisteren/recidiveren ADAMTS13 activiteit <10% is een risicofactor voor een klinisch recidief TTP (RR 6.0 voor recidief binnen 1 jaar).8, 19, 21
Voor progressieve ziekte/recidief ziekte zijn er een aantal behandelmogelijkheden:
*Alle studies met deze middelen laten een effect op de hematologisch respons zien. Er zijn geen data beschikbaar over de immunologische respons (=ADAMTS13 activiteit).
Plasmawisseling
Continueren/ herstarten van plasmawisseling is van deze mogelijkheden het belangrijkst. Indien de TTP progressief is onder plasmawisseling dan is verdere intensivering van wisselingen (2dd/ophogen volume) aangewezen (SORT level B).8
Splenectomie
Voor splenectomie zijn 2 studies verschenen met gunstige uitkomst bij progressieve/refractaire TTP ondanks plasmawisseling en om recidieven te voorkomen.69, 77
In de studie van Kappers-Klunne uit 2005 met 9 patiënten met refractaire ziekte werd in 5 patiënten een snel klinisch herstel gezien. Één patiënt overleed aan progressieve ziekte.77
De Franse studie uit 2012 met 13 patiënten met progressieve ziekte laat een gunstige respons in 12 patiënten zien en 1 overleden patiënt een dag na splenectomie.69
Gezien de snelle respons is er bij acuut bedreigde, refractaire ziekte een plaats voor splenectomie.
NB indien recent rituximab is gegeven, noodzakelijke vaccinaties uitstellen tot 6 maanden na splenectomie met controle van antistof respons.
Cyclofosfamide of ciclosporine
Cyclofosfamide pulse therapie is als salvage therapie beschreven met gunstig resultaat in 5 patiënten (SORT level C).69
Ciclosporine toegevoegd aan plasmawisseling met een behandelduur van 6 maanden leek in 2 klinische prospectieve studies bijdragend aan respons. Vooralsnog wordt dit alleen ingezet bij ontbreken van respons / progressieve ziekte (SORT level B).70-72
Vincristine
Vincristine IV 2 mg dag 1 en 1 mg dag 4+7. Een positieve en snelle respons is gezien in meerdere case series.73-76Vincristine toedienen ná de plasmaferese.
Caplazicumab
Zie paragraaf 5.3.
Gezien ADAMTS13 activiteit prognostisch is voor het optreden van een recidief wordt deze herhaald uiterlijk 6 weken na de laatste dosis caplacizumab, nadien na 3, 6 en 9 maanden gedurende het eerste jaar na het event en (minimaal) 2x per jaar in het tweede jaar. Bij uitblijven van een (immunologisch) recidief volstaat daarna jaarlijkse monitoring, waarbij op individuele basis de controlefrequentie geïntensiveerd kan, bijvoorbeeld vanwege dynamiek van ADAMTS13 activiteit, beginnend herstel van B-cel constitutie na rituximab of voorkeur van patient.
Patiënten met een verlaagde ADAMTS13 activiteit (<10%) na bereiken van een hematologische complete respons hebben een 74% risico op recidief binnen 7 jaar. Pre-emptieve behandeling met rituximab is zeer efficiënt in het voorkomen van een recidief (risicoreductie 74%, number needed to treat 1.6) (SORT level B). Er zijn geen ernstige bijwerkingen waargenomen.
De TTP patiëntenvereniging geeft aan dat veel patiënten een lange nacontrole willen hebben (kwaliteitseis IV) en ook gebaat zijn bij aandacht voor conditioneel fysiek herstel, bijvoorbeeld via een fysiotherapeutisch programma. Patiënten met een doorgemaakte TTP hebben significant vaker klachten van chronische vermoeidheid, depressie, verminderd concentratie vermogen, ervaren een verlaagde vitaliteit en hebben een verhoogde mortaliteit. Mede gezien de noodzaak tot levenslange controles kan TTP inmiddels beschouwd worden als chronische aandoening. Ook komen hypertensie en andere auto-immuunziekten frequenter voor.78, 80
Bij vrouwen moet na een TTP aanval gezorgd worden voor adequate anticonceptie om ongeplande zwangerschap en bijbehorend risico op recidief TTP te voorkomen.
Vrouwen moeten na een TTP aanval bij voorkeur geen orale anticonceptie gebruiken, waarbij oestrogenen waarschijnlijk het grootste risico vormen (SORT level C).8
Er zijn geen goede gegevens beschikbaar over de veiligheid van anticonceptie met uitsluitend progestagenen, maar deze vormen van anticonceptie zijn effectief en vermoedelijk veilig (SORT level C). Er kan hierbij gekozen worden voor:
Gezien de relatieve zeldzaamheid van de aandoening en de grote kans op complicaties verdient het de voorkeur dergelijke zwangerschappen te laten begeleiden in gespecialiseerde centra, waarbij patiënten al verwezen dienen te worden in de preconceptionele fase voor een preconceptioneel onderzoek en advies.
Patiënten moeten op de hoogte gebracht worden van de te verwachten complicaties bij moeder en kind, zoals recidief TTP, pre-eclampsie en foetale dood. M.n. een recidief in het 2e trimester geeft een sterk verhoogd risico op foetale dood t.g.v. een op dat moment nog onvoldoende ontwikkelde placentaire capaciteit. In een USA registratie van 16 zwangerschappen in 10 vrouwen verliepen 10 zwangerschappen (63%) zonder complicaties en leidden 13 (81%) zwangerschappen tot de geboorte van een gezond kind. Recidief TTP trad in 2 zwangerschappen (12.5%) laat in de zwangerschap op en 5 (31%) zwangerschappen werden gecompliceerd door pre-eclampsie.12, 81, 82
Sterk verlaagde ADAMTS13 activiteit (<10%) geeft een grotere kans op een recidief TTP gedurende de zwangerschap met secundaire maternale en foetale complicaties.83 De beperkte case series suggereren dat een normaal ADAMTS13 gehalte sterk voorspellend is voor een veilige ongecompliceerde zwangerschap. In geval van een ADAMTS13 activiteit <10% dient pre-emptief rituximab overwogen te worden; vanwege placentaire passage is het advies om conceptie uit te stellen tot minimaal zes maanden na de laatste gift (zie ook 5.8).12, 84 Indien ADAMTS13 activiteit <10% of sterk dalende activiteit tijdens de zwangerschap optreedt zonder tekenen van klinisch recidief kan als rituximab-sparende behandeling start van prednison met eventueel ook plasma-infusie overwogen worden (SORT level C).
In onderstaande tabel staan de adviezen met betrekking tot frequentie en bepalingen weergegeven.
|
Termijn |
Handelingen |
|
Vanaf 8 weken |
Maandelijks RR controle, bloedbeeld, LDH, bilirubine, ASAT, ALAT, ADAMTS13. |
|
Vanaf 28 weken |
Wekelijks RR controle, bloedbeeld, LDH, bilirubine, ASAT, ALAT. Maandelijks ADAMTS13. |
|
1e week postpartum |
Dagelijks RR controle, bloedbeeld, LDH, bilirubine, ASAT, ALAT. ADAMTS13. |
|
2e en 3e week postpartum |
2x per week RR controle, bloedbeeld, LDH, bilirubine, ASAT, ALAT. |
|
Bij stijging LDH, daling trombocyten |
Dagelijks controle. ADAMTS13. |
|
Bij (beginnende) TTP* |
Start plasmawisseling + corticosteroïden (1 mg/kg) volgens protocol TTP-behandeling. |
* Trombocyten <100 x 109/L, Hb daling >0.5 mmol/L, LDH stijging >20%, fragmentocyten in de differentiatie.
Beleid rond de partus en neonatale controle:
Er ontbreekt casuïstiek omtrent eventuele risico’s voor het pasgeboren kind. Echter, gezien IgG antistoffen de placenta kunnen passeren, is bij nog circulerende antistoffen in voldoende titers op theoretische gronden een risico op TTP activiteit bij het pasgeboren kind niet uit te sluiten. Op basis hiervan komt de werkgroep tot onderstaande adviezen:
Lage tot afwezige ADAMTS13 activiteit zonder aanwezigheid van auto-antistoffen tegen ADAMTS13 wijst op de congenitale vorm van TTP, veroorzaakt door een homozygote of compound heterozygote ADAMTS13 genmutaties.21 Behandeling is gericht op suppletie van functioneel ADAMTS13:
NB Op moment van publicatie van deze richtlijn is op basis van een fase 3 studie recombinant ADAMTS13 (Adzynma)87door de EMA goedgekeurd, maar is in NL de vergoeding nog niet geborgd. Overleg zo nodig bij een casus met de TTP werkgroep.
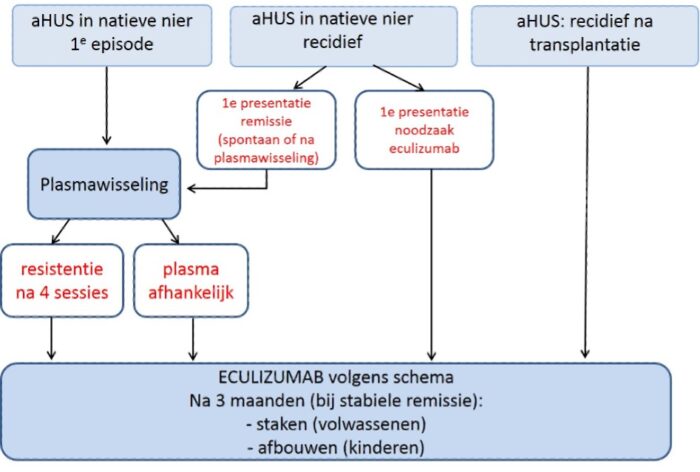
Behandeling van (verdenking op) aHUS met plasmawisseling/eculizumab dient plaats te vinden volgens (consensus) advies van de landelijke werkgroep aHUS (zie figuur 7).
Dit algoritme is volgens de landelijke werkgroep aHUS gebaseerd op resultaten van de prospectieve studies en expertopinie van de werkgroep leden. De volgende uitgangspunten zijn gehanteerd:
Er is sprake van goede respons van aHUS 3 maanden na start eculizumab bij:
Bij goede respons op eculizumab 3 maanden na start:
Vaccinatie
LET OP: voorafgaande aan start eculizumab of tenminste zo snel mogelijk indien eculizumab therapie geïndiceerd is:
Antibiotica profylaxe
Veiligheidsinformatie aan patiënt met betrekking tot eculizumab behandeling
Eculizumab wordt altijd intraveneus toegediend.
|
Gewicht |
Eculizumab (IV) dosering en frequentie |
|
5-10 kg |
week 1+2: 300 mg/dosis 1x per week (inductie) daarna: 300 mg/dosis 1x per 3 weken (onderhoud) |
|
10-20 kg
|
week 1: 600 mg/dosis 1x per week (inductie) week 2: 300 mg/dosis 1x per week daarna: 300 mg/dosis 1x per 2 weken (onderhoud) |
|
20-30 kg |
week 1 t/m 3: 600 mg/dosis 1x per week (inductie) daarna: 600 mg/dosis 1x per 2 weken (onderhoud) |
|
30-40 kg |
week 1+2: 600 mg/dosis 1x per week (inductie) week 3: 900 mg/dosis 1x per week daarna: 900 mg/dosis 1x per 2 weken (onderhoud) |
|
≥ 40 kg |
week 1 t/m 4: 900 mg/dosis 1x per week week 5: 1200 mg/dosis 1x per week (inductie) daarna: 1200 mg/dosis 1x per 2 weken (onderhoud) |
De gepubliceerde klinische trials laten zien dat er meestal een normalisatie van trombocyten aantal optreedt in 7 dagen, gevolgd door normalisatie van LDH rond 14 dagen. Een verbetering in eGFR volgt hierna (eGFR stijgende lijn tot 8-10 weken).
Behandeling bij een recidief aHUS is afhankelijk van de respons op therapie bij eerste presentatie:
Bij de behandeling van deze vorm van aHUS dient volgens de landelijke werkgroep aHUS aan onderstaande uitgangspunten voldaan te worden:
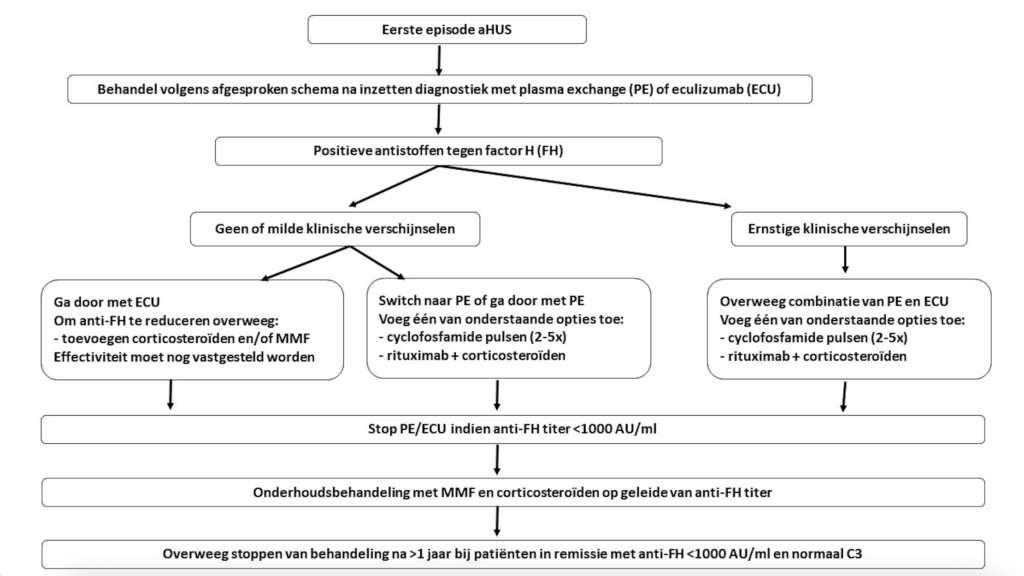
Figuur 8. Behandeling aHUS veroorzaakt door antistoffen tegen factor H
*NB 1: bij de risico-inschatting spelen vele factoren een rol (voorgeschiedenis, eerdere ingrepen, zwangerschappen etc). Voorgesteld wordt om patiënten met een intermediair (matig verhoogd) risico te bespreken om te komen tot consensus over het beleid.
$ NB2: indien er geen pathogene mutaties worden gevonden is het essentieel dat de diagnose aHUS bij de ontvanger terecht is gesteld. Immers, het stellen van de diagnose aHUS zal leiden tot het niet accepteren van een verwante donor.
NB: Er worden geen adviezen gegeven voor patiënten die eerder transplantatie hebben ondergaan (met recidief aHUS) of voor patiënten met een ernstige de novo TMA na transplantatie. Dit zijn uitzonderlijke situaties, die zullen worden besproken in de landelijke aHUS werkgroep.
Bij vrouwen moet na HUS episode gezorgd worden voor adequate anticonceptie om ongeplande zwangerschap en bijbehorend risico op recidief HUS te voorkomen.
Vrouwen moeten na een aHUS episode bij voorkeur geen orale anticonceptie gebruiken, waarbij oestrogenen waarschijnlijk het grootste risico vormen (SORT level C).8
Er zijn geen goede gegevens beschikbaar over de veiligheid van anticonceptie met uitsluitend progestagenen, maar deze vormen van anticonceptie zijn effectief en vermoedelijk veilig (SORT level C). Er kan hierbij gekozen worden voor:
In het algemeen is een zwangerschap voor een patiënte met aHUS een groot risico, maar door de ontwikkeling van eculizumab zijn er inmiddels wel meer mogelijkheden voor zwangerschap bij deze patiënten en er zijn al de nodige case series met toediening van eculizumab tijdens de zwangerschap bij patiënten met aHUS, HELPP en paroxysmale nachtelijke hemoglobinurie.89 Algemene richtlijnen zijn niet te maken. Gezien de relatieve zeldzaamheid van de aandoening en de voortdurend nieuwe ontwikkelingen bij de behandeling en preventie van aHUS is het raadzaam om dergelijke patiënten met zwangerschapswens te verwijzen naar één van de universitaire centra voor preconceptioneel onderzoek en advies.
Sterkte van aanbevelingen op basis van SORT systematiek

Radboudumc
AMC
Erasmus MC
MUMC
LUMC
UMC Groningen
UMC Utrecht
VUMC
Anno september 2024 heeft de commissie Beoordeling Add-on Geneesmiddelen van Zorgverzekeraars Nederland (cieBAG) een positief oordeel afgegeven en is behandeling met caplacizumab in onderstaande centra mogelijk:
|
Albert Schweitzer Ziekenhuis, Dordrecht |
|
Amphia Ziekenhuis, Breda |
|
Amsterdam Universitair Medisch Centrum, Amsterdam |
|
Catharina Ziekenhuis, Eindhoven |
|
Carnisius Ziekenhuis, Nijmegen |
|
Erasmus Medisch Centrum, Rotterdam |
|
Flevoziekenhuis, Almere |
|
Franciscus Gasthuis, Rotterdam |
|
Gelre Ziekenhuizen, Apeldoorn |
|
HagaZiekenhuis, Den Haag |
|
Isala Kliniek, Zwolle |
|
Jeroen Bosch Ziekenhuis, ’s Hertogenbosch |
|
Leids Universitair Centrum, Leiden |
|
Maasstad Ziekenhuis, Rotterdam |
|
Maastricht Universitair Centrum, Maastricht |
|
Maxima Medisch Centrum, Eindhoven |
|
Meander MC, Amersfoort |
|
Medisch Centrum Leeuwarden, Leeuwarden |
|
Medisch Spectrum Twente, Enschede |
|
OLVG, Amsterdam |
|
Radboud Universitair Medisch Centrum, Nijmegen |
|
Rijnstate Ziekenhuis, Arnhem |
|
St. Antonius, Nieuwegein |
|
Universitair Medisch Centrum Groningen, Groningen |
|
Universitair Medisch Centrum Utrecht, Utrecht |
|
Zuyderland, Heerlen |
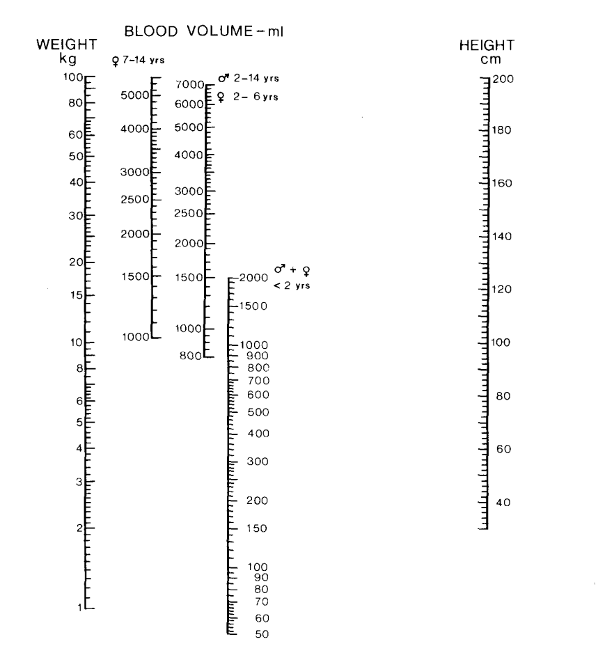
Nadler formule totaal bloedvolume (L)48
Waarbij: Ht = hematocriet; G = gewicht (kg)
Linderkamp monogram49
Trek een lijn tussen gewicht en lengte en lees het bijbehorende bloedvolume af op de voor geslacht en leeftijd specifieke verticale balk.
Op moment van publicatie van deze richtlijn is een aanvraag voor uitbreiding van indicatiegebied van rituximab in de eerstelijnsbehandeling van verworven TTP in behandeling. Tot moment van toekenning van vergoedingsindicatie kan ervoor gekozen worden om de werkwijze uit de richtlijn versie 2021 te volgen, d.w.z. initiële start met plasmaferese, caplacizumab en prednison gevolgd door responsevaluatie en eventuele aanpassing van behandeling vanaf dag 7:
Vanaf dag 7 wordt zowel de hematologische als immunologische respons beoordeeld.
Indien hematologische complete respons wordt plasmawisseling gestaakt. 72 uur na de laatste plasmawisseling wordt ADAMTS13 activiteit bepaald (NB dit interval dient ter voorkoming van een foutief-normaal resultaat voor ADAMTS13 activiteit als gevolg van ADAMTS13 substitutie terwijl nog wel actieve TMA). Indien sprake is van een immunologische complete respons (ADAMTS13 activiteit ≥10%) wordt caplacizumab gestaakt en prednison afgebouwd in 2-3 weken. Indien geen sprake is van een immunologische complete respons worden caplacizumab en prednison gecontinueerd en wordt tevens gestart met tweedelijns immunosuppressieve behandeling middels rituximab (375 mg/m2, 1x/week gedurende 4 weken) (SORT level B). ADAMTS13 activiteit wordt 2x/week bepaald tot een immunologische complete respons bereikt is waarbij gehandeld wordt zoals hierboven beschreven.
Indien op dag 7 géén hematologische complete respons is bereikt worden caplacizumab en prednison 1 mg/kg gecontinueerd en wordt tevens gestart met tweedelijns immunosuppressieve behandeling middels rituximab (375 mg/m2, /week gedurende 4 weken) (SORT level B). Vanuit farmacokinetisch oogpunt kan overwogen worden om de 4 giften rituximab in een frequentie van 2x per week toe te dienen, zolang er ook plasmaferese plaatsvindt. Alhoewel het dosisinterval geen effect heeft op de snelheid van bereiken en diepte van B-cel depletie en de klinische meerwaarde vooralsnog onduidelijk is, wordt met dit schema sneller 1x adequate dalspiegels van rituximab bereikt. In geval van geen respons of progressieve ziekte kan overwogen worden om de plasmawisselingen te intensiveren (2dd à 1.0 plasmavolume).
Evaluatie en vervolgbeleid nadien:
Overleg in deze situatie laagdrempelig met de TTP werkgroep over timing en keuze van behandeling (middels privacy-veilige TTP siilo app).
© 2022. Alle rechten voorbehouden
Werkgroep niet-oncologische hematologie van de Nederlandse Vereniging voor Hematologie
Nederlandse Federatie voor Nefrologie