De ISPD guideline ‘Prescribing high-quality goal-directed peritoneal dialysis’ uit 2020 vervangt de ISPD guideline ‘Guideline on targets for solute and fluid removal in adult patients on chronic peritoneal dialysis’ uit 2006.
Een werkgroep van KDIGO heeft voorgesteld om in de toekomst niet meer te spreken over ‘dialyse adequaatheid’, maar over ‘doelgerichte dialyse’ waarbij gebruik wordt gemaakt van gedeelde besluitvorming door de patiënt, diens mantelzorger en het multidisciplinair behandelteam.
In de richtlijn uit 2006 lag de nadruk nog op de klaring van kleine moleculen bij het bepalen of er sprake was van adequate peritoneale dialyse (PD).3 Sinds 2006 is het landschap van PD echter aanzienlijk veranderd, onder andere doordat de dialysepopulatie is verouderd.4 Mede hierdoor zijn meer factoren dan dialyse efficiëntie van belang voor de kwaliteit van de dialyse behandeling, af te meten aan de overleving en het welbevinden van patiënten en diens omgeving.
Om te zorgen voor een hoogwaardige behandeling dient rekening te worden gehouden met de beperkingen, voorkeuren en doelen van de individuele patiënt en gedeelde besluitvorming te worden toegepast. Er wordt gestreefd naar behoud van restnierfunctie, euvolemie, voorkomen van uremische klachten, optimaliseren van voedingstoestand, en voorkomen van complicaties zoals PD gerelateerde infecties of therapiefalen. Deze aanpak is in overeenstemming met het ‘standardized outcomes in nephrology PD initiative’ waarbij aan patiënten, mantelzorgers en behandelaren gevraagd werd wat voor hen de belangrijkste uitkomstmaten zijn.5 Dit waren PD-gerelateerde infecties, cardiovasculaire ziekte, overlijden, PD-falen en participatie in de samenleving. Met name het behoud van restnierfunctie is geassocieerd met betere uitkomsten. Het bewijs dat een hogere klaring van kleine moleculen met PD invloed heeft op deze uitkomstmaten is slechts van lage kwaliteit behoudens bij de kleine groep patiënten die over moeten stappen op hemodialyse op basis van onvoldoende klaring.6 Deze verschuiving van de focus bij het voorschrijven van een dialysebehandeling vormt de basis voor de aanbevelingen in deze vernieuwde richtlijn. Het streven van ‘hoogwaardige doelgerichte peritoneale dialyse’ is het bereiken van de maximaal haalbare gezondheidswinst door behoud van kwaliteit van leven met minimale hinder door de behandeling. De verschillende componenten die bijdragen aan hoogwaardige doelgerichte peritoneale dialyse zijn samengevat in figuur 1 en worden verder toegelicht in de rest van deze richtlijn.
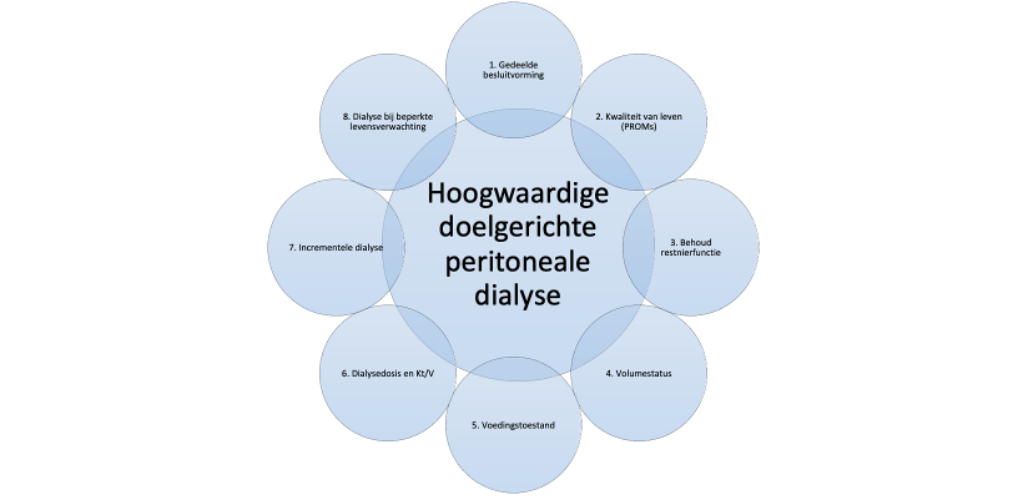
Figuur 1. Componenten die bijdragen aan hoogwaardige doelgerichte peritoneale dialyse
E.E. van Eeghen, internist-nefroloog i.o. Amsterdam UMC
A.C. Abrahams, internist-nefroloog UMC Utrecht
C.W.H. de Fijter, internist-nefroloog OLVG Amsterdam
A.J. Aarnoudse, internist-nefroloog Catharina Ziekenhuis Eindhoven namens de richtlijncommissie
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is voor een individuele patiënt. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van goede zorg voor de patiënt, van een richtlijn moet worden afgeweken.
Deze richtlijn dient ter vervanging van de in 2018 verschenen NFN richtlijn ‘Peritoneale dialyse effectiviteit en monitoring membraanfunctie bij PD’. De ISPD heeft recent over deze twee onderwerpen twee aparte guidelines uitgebracht:
Deze 2 onderwerpen zullen in 2 aparte NFN-richtlijnen besproken worden.
In deze richtlijn zal het onderwerp ‘Hoogwaardige doelgerichte peritoneale dialyse’ besproken worden. Het betreft een aanpassing van deze internationale richtlijn voor de Nederlandse praktijk. Voor meer achtergrondinformatie verwijzen wij naar de ISPD guideline.
Over het onderwerp ‘Evaluatie van de peritoneale membraanfunctie’ is een aparte NFN richtlijn verschenen.
In beide richtlijnen wordt gebruik gemaakt van de GRADE methode om de kracht en het achterliggende bewijs van de verschillende aanbevelingen te graderen. De graderingen zijn in deze richtlijn grotendeels overgenomen. Enkele aanbevelingen zijn niet gegradeerd omdat deze op grond van wetenschappelijk onderzoek slechts een zwakke aanbeveling krijgen, maar desalniettemin de in deze richtlijn beoogde kernwaarden voor het leveren van patiëntenzorg behelzen.
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn: ‘Person-centered peritoneal dialysis prescription and the role of shared decision-making’ en is aangepast aan de Nederlandse praktijk. 1
De persoonlijke voorkeuren en behoeftes van de patiënt dienen voor zover mogelijk leidend te zijn bij het kiezen van een peritoneale dialyse (PD) modaliteit of voorschrift. Hierbij kan worden gesteld dat gedeelde besluitvorming in het verlengde ligt van informed consent. Hiervoor is het essentieel dat de behandelaar in gesprek gaat met de patiënt over zijn individuele levens- en behandeldoelen, en kwaliteit van leven en ervaren symptomen (i.e. patient reported outcome measures, PROMs). Om de patiënt mee te laten beslissen over de behandeling is educatie over de verschillende behandelmogelijkheden inclusief voor- en nadelen noodzakelijk. Daarnaast moet worden stilgestaan bij de vooruitzichten op de korte, middellange en lange termijn. Dit leidt tot patiëntparticipatie hetgeen behalve moreel wenselijk, ook gecorreleerd is met betere uitkomsten. 2 Gedeelde besluitvorming en patiënt gecentreerde zorg betreffen niet alleen het PD voorschrift, maar ook de wens tot het afbouwen van PD in de laatste levensfase, de wens om getransplanteerd te worden, of het wisselen van modaliteit (i.e naar centrumhemodialyse of thuishemodialyse). Vaak zijn beslissingen op dit gebied niet zwart-wit en is er ruimte om de voorkeur van de patiënt mee te wegen. Goede communicatie over deze ingrijpende wijzigingen in de behandeling zijn essentieel om negatieve emoties zoals verwarring, somberheid en boosheid te voorkomen. 1
Er zijn meerdere potentiële barrières voor het toepassen van patiëntgerichte zorg en gedeelde besluitvorming. Enerzijds aan de kant van de patiënt kunnen er verminderde cognitieve vermogens, angst, depressie, en culturele verschillen bestaan. Anderzijds zorgen aan de kant van het behandelteam een gebrek aan tijd door een medische spoedsituaties of de organisatie van zorg en gebrek aan ervaring met het toepassen van gedeelde besluitvorming of verlenen van palliatieve zorg eveneens voor uitdagingen. 3 Hoewel dit een realiteit is in onze dagelijkse werkzaamheden is dit geen excuus om hier niet naar te streven.
Het bereiken van de door de patiënt geformuleerde doelen, verlichting van symptomen, en zijn/haar ervaringen ten aanzien van deelname aan de besluitvorming en participatie in de samenleving dienen tenminste 6-maandelijks te worden geëvalueerd. Hierop kan de behandeling worden aangepast. Zie hiervoor ook hoofdstuk 2.
Toelichting
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn ‘Health-related quality of life and adequacy of dialysis for the individual maintained’ en aangepast naar de Nederlandse praktijk. 1
Eindstadium nierfalen en dialysebehandeling hebben grote impact op de kwaliteit van leven. Een integraal onderdeel van de behandeling van dialysepatiënten behelst het samen evalueren en optimaliseren van de kwaliteit van leven (‘health-related quality of life’, HRQoL). 2
Om hoogwaardige dialysebehandeling mogelijk te maken dienen patiënt en behandelaar regelmatig stil te staan bij diens kwaliteit van leven, ervaren klachten en functionele beperkingen. Deze factoren kunnen vervolgens worden gebruikt om met behulp van gedeelde besluitvorming de dialysebehandeling aan te passen aan de individuele behoeften van de patiënt. Hierbij dient gebruik te worden gemaakt van patiënt gerapporteerde uitkomsten. In Nederland is door Nefrovisie, in samenwerking met de Nierpatiënten Vereniging Nederland en de Nederlandse Federatie voor Nefrologie, een vragenlijst samengesteld (‘patient reported outcome measures’, PROMs) die bestaat uit 12 algemene vragen (i.e. Short-Form 12) en 30 vragen over ziekte-specifieke symptomen die patiënten ervaren (i.e. Dialysis Symptom Index). De richtlijncommissie adviseert om de PROMs-vragenlijst bij voorkeur iedere 6 maanden aan te bieden om vervolgens de uitslagen te bespreken en de behandeling aan te passen. Dit kan tijdens een jaarcontrole, een polikliniek bezoek of ter voorbereiding op een multidisciplinair overleg (MDO).
De relatie tussen dialysedosis en HRQOL is niet eenduidig. Enerzijds zal het verhogen van het aantal wisselingen invloed hebben op de behandellast. Anderzijds kan te weinig dialyse leiden tot uremische symptomen. De Hong Kong studie toonde aan dat patiënten met een Kt/V < 1.7 gemiddeld genomen meer klachten hadden. Tegelijkertijd is er geen bewijs dat een hogere dialysedosis geassocieerd is met verbetering van HRQOL. 3-5
Referenties
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn ‘Prescribing high-quality peritoneal dialysis: The role of preserving residual kidney function’ en aangepast naar de Nederlandse praktijk. 1
Behoud van restnierfunctie is een belangrijk behandeldoel bij peritoneale dialyse (PD) patiënten aangezien het een belangrijke determinant is van kwaliteit van leven en overleving. Dit geldt zowel voor urinevolume als voor klaring van kleine, middelgrote en eiwitgebonden uremische toxines. Patiënten die worden behandeld met PD behouden hun restnierfunctie meestal langer dan patiënten die worden behandeld met intermitterende hemodialyse. 2
De richtlijncommissie adviseert om de restnierfunctie ieder kwartaal te bepalen door middel van het sparen van 24 uurs urine om hiermee volume en gemiddelde ureum-kreatinine klaring te bepalen. Op deze manier kan tijdig geanticipeerd worden op het verlies van restnierfunctie, bijvoorbeeld door het PD voorschrift aan te passen.
Er zijn verscheidene strategieën die bijdragen aan het zo lang mogelijk behouden van de restnierfunctie. Intravasculaire ondervulling en hypotensie zijn geassocieerd met sneller verlies van restnierfunctie en dienen daarom te worden voorkomen. Aan de andere kant is een teveel aan extracellulair vocht niet geassocieerd met een langer behoud van restnierfunctie maar wel met een hogere mortaliteit. 3 Diuretica en icodextrine kunnen gebruikt worden om overvulling te behandelen zonder dat dit ten koste gaat van restnierfunctie. 4.5
Verder is het gebruik van dialysevloeistoffen met een neutrale pH en lage concentratie van glucose degradatie producten (GDP’s) geassocieerd met een langer behoud van restnierfunctie. Meest waarschijnlijk komt dit doordat deze vloeistoffen leiden tot minder systemische inflammatie. 4
Het gebruik van ACE remmers of angiotensine-2 receptor blokkers is in verscheidene studies geassocieerd is met een langer behoud van restnierfunctie. 6 Derhalve worden deze middelen aangeraden als eerste keus antihypertensivum bij PD patiënten, mits er geen contra-indicaties bestaan. Deze middelen zijn bovendien geassocieerd met een afname van linker ventrikel hypertrofie en verminderde cardiovasculaire sterfte. Gebruik van spironolacton of furosemide is niet geassocieerd met langer behoud van restnierfunctie. 7
Gebruik van aminoglycosiden is geassocieerd met een verhoogd risico op acute nierschade in de algemene populatie. Dit veronderstelt ook terughoudendheid in het gebruik bij PD patiënten met restnierfunctie. In deze populatie is echter niet aangetoond dat kortdurend gebruik met adequate spiegels geassocieerd is met verlies van restnierfunctie. 8Gebruik langer dan 3 weken dient wel te worden vermeden in verband met het risico op ototoxiciteit.
Gebruik van intraveneus jodiumhoudend contrast is in de algemene populatie eveneens geassocieerd met een verhoogd risico op acute nierschade. 9 In enkele observationele studies werd echter geen aanhoudend verlies van restnierfunctie gezien bij PD patiënten na toediening van intraveneus jodiumhoudend contrast. 10-12 Desalniettemin wordt geadviseerd om indien mogelijk terughoudend te zijn met het gebruik van intraveneus jodiumhoudend contrast, waarbij overwogen kan worden gebruik te maken van een andere beeldvormingstechniek, en te zorgen dat patiënt ten tijde van het onderzoek voldoende gehydreerd is.
Er is onvoldoende bewijs dat continue ambulante peritoneale dialyse (CAPD) of automatische peritoneale dialyse (APD) superieur is ten aanzien van het behoud van restnierfunctie. 13,14 Er zijn wel aanwijzingen dat het starten met incrementele dialyse geassocieerd is met een langer behoud van restnierfunctie, al toonde de laatste gerandomiseerde studie verricht in China onder 137 patiënten geen verschil aan. 15-17
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn ‘Volume management as a key dimension of a high-quality PD prescription’ en aangepast naar de Nederlandse praktijk. 1
Overvulling komt vaak voor bij peritoneale dialyse (PD) patiënten; het is beschreven bij 25 tot 67% van de patiënten. 2-4 Een systematische review en meta-analyse toonde dat overvulling, vastgesteld met bio-impedantie analyse (BIA), bij dialysepatiënten een voorspeller was van mortaliteit, onafhankelijk van comorbiditeit. 5 Deze bevindingen onderstrepen het belang van het bereiken en behouden van een optimale volumestatus. In een kleine (n=66), kortdurende (6 maanden) gerandomiseerde studie werd een reductie bereikt in het aantal overvullingsgerelateerde ziekenhuisopnames met een multi-disciplinaire aanpak gericht op strikte volumeregulatie. 6 Belangrijk is om ondervulling te voorkomen aangezien dit tot verlies van restnierfunctie kan leiden. 7 Er is echter geen bewijs dat het nastreven van een ruimere vullingstatus leidt tot langer behoud van restnierfunctie.
Zowel de hoeveelheid restdiurese als het peritoneale ultrafiltratie volume zijn geassocieerd met een betere overleving. 8 Heranalyse van de CANUSA studie toonde dat elke 250 ml restdiurese het sterfterisico met 36% reduceerde (95% CI 0,51-0,80). 9 In een kleine gerandomiseerde studie leidde het gebruik van lisdiuretica tot een relatieve toename van de urineproductie en een betere volumestatus. 10 Een andere single center gerandomiseerde studie toonde aan dat de urineproductie nog verder kan worden verhoogd met het toevoegen van een thiazide- en kaliumsparend diureticum aan een maximale dosering lisdiuretica. 11
Een dialysevoorschrift dat leidt tot netto resorptie van vocht dient te worden vermeden. Bij anure PD patiënten is een ultrafiltratie volume onder de 750 ml per 24 uur geassocieerd met een verhoogde mortaliteit.1 Een optimaal ultrafiltratie volume voor niet-anure patiënten is echter moeilijk vast te stellen want dit is afhankelijk van restnierfunctie, intake en lichaamssamenstelling.
Bloeddruk is een belangrijke parameter bij het evalueren van het PD voorschrift. Zowel hypertensie (> 140/90 mmHg) als hypotensie (systolische RR < 100 mmHg) komt bij PD patiënten frequent voor, bij respectievelijk 50-90% en 12% van de patiënten. 12,13 Bloeddruk wordt bij dialysepatiënten in sterke mate beïnvloed door volumestatus en natrium inname.
Er zijn geen prospectieve gerandomiseerde studies uitgevoerd bij PD patiënten naar bloeddrukdoelen en de invloed hiervan op klinische uitkomsten. De resultaten uit retrospectief onderzoek zijn tegenstrijdig, en sterk getekend door bias. Wel is duidelijk dat er een epidemiologische relatie bestaat tussen bloeddruk en uitkomsten in PD patiënten waarbij zowel hoge als lage bloeddruk geassocieerd zijn met slechtere uitkomsten. Dit laatste wordt mogelijk gemedieerd door een verminderde cardiale functie. 14
Er is op dit moment geen specifieke streefbloeddruk vast te stellen voor PD patiënten. Derhalve wordt geadviseerd om dezelfde bloeddruk doelen na te streven als geadviseerd in de richtlijn ‘Chronische nierschade’ van de Nederlandse Internisten Vereniging: in de spreekkamer 130/80 mmHg.
De richtlijncommissie adviseert de bloeddruk en vullingsstatus bij PD patiënten elk polikliniek bezoek te evalueren, en de bloeddruk tenminste één keer per week, maar bij voorkeur dagelijks thuis te meten. Het verdient aanbeveling om dit op een vast moment op de dag te doen.
Er bestaat geen gouden standaard voor het beoordelen van de vullingsstatus. Er wordt aanbevolen hiervoor de traditionele methoden bij lichamelijk onderzoek te gebruiken zoals het beoordelen van de aanwezigheid van pitting oedeem, centraal veneuze druk, longgeluiden, bloeddruk liggend en staand en veranderingen in lichaamsgewicht.
Andere methoden als aanvulling op de klinische beoordeling zoals bio-impedantie analyse (BIA), N-terminaal pro-Brein Natriuretisch Peptide (NT-proBNP), en longechografie zijn ook onderzocht. De rol van BIA ter voorkoming van onder- en overvulling bij PD patiënten is onderzocht in een aantal gerandomiseerde studies. Een recente meta-analyse van 7 gerandomiseerde studies met 1312 dialysepatiënten liet geen verbetering zien in overleving bij patienten bij wie BIA werd toegepast (RR 0,87, 95%CI 0,54-1,39). Er was wel een positief effect op bloeddrukregulatie gezien met een daling systolisch van 2,73 mmHg (95% CI 0,46 – 5,00). 15-17
NT-proBNP is minder geschikt als indicator van vullingsstatus aangezien dit renaal geklaard wordt en ook (beperkt) tijdens PD. 18 Het hangt sterk samen met de aanwezigheid van restnierfunctie en is daarnaast ook afhankelijk van de cardiale functie. 19 Longechografie is een veelbelovende techniek voor semi-kwantitatieve inschatting van longoedeem en pleuravocht, en is hierin accurater dan een X-thorax. 20 De aanwezigheid van pulmonale overvulling gezien met longechografie is geassocieerd met een grotere kans op sterfte bij hemodialyse patiënten. 21Studies die de toegevoegde waarde van longechografie in het voorkomen van overvulling en sterfte evalueren bij hemodialyse patiënten lopen op dit moment. Derhalve kan in deze richtlijn nog geen aanbeveling gedaan worden over het gebruik van longechografie bij PD patiënten.
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn “Prescribing high quality peritoneal dialysis: moving beyond urea clearance” en betreft een aanpassing naar de Nederlandse praktijk. 1
Bij PD patiënten dient naar een goede voedingsstatus te worden gestreefd. Bij 55-75% is dit onvoldoende het geval. 2 De combinatie van ondervoeding, systemische inflammatie en dialyse gerelateerd katabolisme dragen samen bij aan het verlies van spiermassa. Dit fenomeen wordt protein energy wasting (PEW) genoemd. De aanwezigheid PEW kan worden beoordeeld en gecategoriseerd aan de hand van de subjectieve global assessment (SGA) aangevuld met routine laboratoriumonderzoek. PEW wordt onder meer veroorzaakt door een combinatie van verminderde intake (ten gevolge van mechanische bezwaren van een te groot volume PD vloeistof in de buik, glucosebelasting en uremische toxines), verlies van albumine en andere eiwitten met de dialyse, en overvulling. 3-6PEW is geassocieerd met slechte klinische uitkomsten. Derhalve wordt aanbevolen de aanwezigheid hiervan elk 6 maanden te evalueren met een SGA en eventueel vaker indien er aanwijzingen zijn voor een slechte voedingstoestand. Er is echter weinig bewijs dat specifieke interventies gericht op het tegengaan van PEW, zoals het gebruik van aminozuur-bevattende PD vloeistoffen, leiden tot betere uitkomsten. 7 Mogelijk komt dit voort uit de multifactoriële genese van PEW.
Hoewel elektrolytschommelingen minder groot zijn bij PD dan bij hemodialyse, zijn zowel hypo- als hyperkaliëmie ook in deze groep geassocieerd met een verhoogde mortaliteit. 8 Zo is hypokaliëmie geassocieerd met een slechte voedingsstatus en het optreden van peritonitis, met name met bacteriën behorende tot de groep Enterobacteriaceae. 9 Door het gebruik van een kaliumrijk dieet, kalium supplementen en/of kaliumsparende diuretica kan het serum kalium worden genormaliseerd. Het is echter niet bewezen dat dit leidt tot betere uitkomsten. 10 Desalniettemin wordt geadviseerd om normokaliëmie na te streven met behulp van deze interventies.
In retrospectief onderzoek is een associatie gevonden tussen hyperfosfatemie en mortaliteit. 11,12 Op basis van deze beperkte gegevens wordt geadviseerd een normaal serum fosfaat na te streven. Om dit te bereiken kan gebruik gemaakt worden van een fosfaatbeperkt dieet, fosfaatbinders en optimalisatie van het dialysevoorschrift. 13Daarnaast levert vooral de aanwezigheid van eventuele restnierfunctie een belangrijke bijdrage aan fosfaatklaring.
Hypoalbuminemie komt vaker voor bij PD patiënten dan bij HD patiënten, mogelijk door peritoneaal verlies van eiwitten waaronder albumine. 14 In een retrospectieve studie hadden PD patiënten met een albumine onder de 30 gram/L een drievoudig verhoogd risico op overlijden in vergelijking met HD patiënten. Zowel serum albumine, en in het verlengde de aanwezigheid van systemische inflammatie zijn gerelateerd aan de voedingstoestand. Derhalve dienen potentiële strategieën gericht op het voorkomen van eiwitverlies te worden aangegrepen. 15 Er bestaat echter geen één op één relatie tussen ondervoeding en hypoalbuminemie. 16 Er is vooralsnog geen bewijs dat een voedingsinterventie zorgt voor een hoger serum albumine of minder peritoneaal eiwit verlies. Wel kan met ACE remmers of angiotensine-2 receptorblokkers albuminurie worden verminderd. Mogelijk dat ACE remmers ook leiden tot verminderd peritoneaal eiwit verlies door het remmen van VEGF en TGF-beta. 17,18
Voor specifieke adviezen over voeding bij PD patiënten verwijzen wij naar de richtlijn “Dieet bij peritoneale dialyse” van Diëtisten Nierziekten Nederland uit 2020.
Voor de aanbevolen minimale frequentie van het monitoren van de verscheidene bloedwaarden verwijzen wij naar de richtlijn “Laboratorium bepalingen en periodiek onderzoek bij stabiele dialyse patiënten.” van de Nederlandse Federatie voor Nefrologie uit 2016.
Dit hoofdstuk is gebaseerd op de corresponderende hoofdstukken uit de ISPD richtlijn: ‘2005 Guidelines on targets for solute and fluid removal in adults being treated with chronic peritoneal dialysis: 2019 Update of the literature and revision of recommendations’ en ‘Accuracy of the estimation of V and the implications this has when applying Kt/Vureum for measuring dialysis dose in peritoneal dialysis’ en aangepast aan de Nederlandse praktijk. 1,2
In verscheidene prospectieve studies is aangetoond dat de aanwezigheid van restnierfunctie, in tegenstelling tot peritoneale klaring, is geassocieerd met een betere overleving. 3-6 Het optellen van peritoneale klaring en restnierfunctie om een gecombineerde Kt/Vureum te berekenen is niet onderzocht op klinische eindpunten. Desalniettemin, gezien de eenvoudige en brede toepassing, wordt het nut hiervan ingezien om te kunnen anticiperen op onderdialyse bij verlies van restnierfunctie.
In 1985 werd in navolging van hemodialyse, Kt/V geïntroduceerd als maat voor de dialysedosis bij peritoneale dialyse (PD) patiënten. 7 De Hong Kong en ADEMEX studies onderzochten gerandomiseerd het voordeel van het nastreven van een Kt/Vureum > 1,7 en 1,8. Er werd geen verschil gevonden in overleving of kwaliteit van leven tussen de verschillende groepen. 3,8 In de Hong Kong studie ontwikkelde de groep met een streef Kt/Vureum van 1,5-1,7 wel meer complicaties dan de groepen met een Kt/V > 1,7. Zo werden ze vaker door hun behandelaar teruggetrokken uit de studie en hadden ze meer erytropoëtine nodig. Daarnaast toonde de Nederlandse NECOSAD studie een verhoogd risico op mortaliteit in PD patiënten zonder restnierfunctie met een Kt/Vureum < 1,5. 9
Kt/Vureum als maat voor de dialysedosis kent echter een aantal beperkingen. Ten eerste legt het de nadruk op klaring van kleine moleculen waarbij er weinig bewijs is dat de bereikte Kt/Vureum een goede surrogaat marker is voor overleving of ziektelast. 3,10 Ten tweede is de schatting van het verdelingsvolume van ureum (V) onbetrouwbaar waarbij de vraag is of deze moet worden bepaald aan de hand van vetvrije massa, om zo overdialyse in obese en onderdialyse in cachectische patiënten te voorkomen. 11 Desondanks bestaat er van oudsher een sterke behoefte aan een richtsnoer voor de benodigde dialysedosis die op enige manier in verhouding staat tot de grootte en metabole behoefte van de individuele PD patiënt.
Op dit moment wordt het verdelingsvolume van ureum (Vureum) gelijk gesteld aan het totaal lichaamswater (‘total body water’, TBW) aangezien ureum zeer goed water oplosbaar is en makkelijk door de celmembraan beweegt. Om TBW te berekenen bestaan verschillende methodes. De antropometrische formule van Watson wordt het vaakst gebruikt om het TBW te schatten. 12 De gouden standaard om het TBW te berekenen is verdunning met water-isotopen. Deze methode is echter weinig praktisch voor de dagelijkse praktijk. Er zijn verscheidene studies verricht in dialysepatiënten die de betrouwbaarheid van de Watson formule hebben onderzocht ten opzichte van isotoop-verdunning. Hieruit bleek dat de Watson formule op niveau van de individuele patiënt een vrij grote foutmarge had. Zo was voor een doorsnee patiënt met een TBW van 35L en een Kt/V van 1,7 per week het 95% betrouwbaarheidsinterval van de Kt/V 1,44-2,06. Er bestaan hierbij belangrijke verschillen in ras, geslacht en lichaamssamenstelling ten aanzien van onder- en overschatting van het TBW waarbij het risico het grootste is op onderschatting van TBW bij mannen met een donkere huidskleur. Bij patiënten met een sterk afwijkende lichaamssamenstelling kan overwogen worden om te werken met het ideaal gewicht in plaats van met het werkelijk gewicht. Met name bij ondervoede patiënten waarbij het risico bestaat op overschatting van de Kt/V valt hier iets voor te zeggen. Een bijkomend voordeel is dat het makkelijker is Kt/V serieel te vervolgen. Als dit vergeleken wordt met de accuratesse van bioimpendantie analyse (BIA) ten opzicht van de isotoop-dilutie methode ontloopt dit elkaar niet veel. Zo is voor de patiënt met een TBW van 35L en Kt/V van 1,7 het 95% betrouwbaarheidsinterval dan 1,44-1,94. Op populatieniveau komen de antropometrische methode en bioimpedantie methode wel goed overeen met isotoop-dilutie aangezien de onbetrouwbaarheid gedreven wordt door interindividuele verschillen in lichaamssamenstelling. 1 Gebruik van rustmetabolisme, als maat voor productie van uremische toxines, om de dialysebehoefte te bepalen is onvoldoende onderzocht maar kent waarschijnlijk ook problemen aangezien juist bij ondervoede patiënten met uremische klachten deze methode onbetrouwbaar zal zijn gegeven hun afwijkende lichaamssamenstelling.
De aanbeveling om geen universeel Kt/Vureum doel na te streven bij patiënten met restnierfunctie is een verandering ten opzichte van de eerdere ISPD richtlijn. Sindsdien zijn er geen nieuwe resultaten bekend geworden uit gerandomiseerde onderzoeken over na te streven Kt/Vureum doelen. Het is onwaarschijnlijk dat deze in de toekomst nog zullen verschijnen.
De aanbeveling om bij het aanpassen van de dialysedosis de symptomen van de patiënt en de behandeldoelen mee te wegen komt enerzijds voort uit de beperkingen van de Kt/Vureum bij een individuele patiënt en anderzijds de beperkte associatie van Kt/Vureum met klinische uitkomsten. Bij patiënten zonder restnierfunctie dient echter op grond van de gegevens uit de Hong Kong en NECOSAD studies gestreefd te worden naar een KtVureum > 1,5. 7,8 Ook wordt geadviseerd om in deze groep gedurende 24 uur te dialyseren en schema’s met een ‘droge buik’ te vermijden. Zo kan de klaring van middel-grote moleculen verbeterd worden. Hierbij moet opgemerkt worden dat er geen streefwaarden zijn voor middel-molecuul klaring en de invloed hiervan op morbiditeit en mortaliteit onvoldoende zijn onderzocht. 13
Toelichting
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn ‘Incremental peritoneal dialysis’ en aangepast naar de Nederlandse praktijk. 1
Onder incrementele (peritoneale) dialyse wordt verstaan een dialysevoorschrift met een lagere dosis dat rekent op additionele klaring in de vorm van restnierfunctie om het beoogde doel te halen. Hierbij dient nauwlettend gelet te worden op verlies van restnierfunctie, overvulling, en het optreden van uremische symptomen waarop de dialysedosis dient te worden verhoogd. Dit wordt nader beschreven in hoofdstukken 3 en 6.
De meeste patiënten die starten met peritoneale dialyse (PD) hebben nog restnierfunctie. Starten met een lagere dialysedosis heeft dan als voordeel dat de behandeling beter in te passen is in het dagelijks leven gezien het kleiner aantal wisselingen, wat mogelijk leidt tot betere participatie in de samenleving. Een kleiner inloopvolume geeft bij patiënten mogelijk ook minder mechanische bezwaren zoals zuurbranden. Ook de kosten van de behandeling zouden potentieel lager kunnen zijn. Aangezien patiënten aan een lagere hoeveelheid glucose-bevattende dialysevloeistoffen worden blootgesteld leidt dit mogelijk ook tot minder lokale en systemische bijwerkingen en een langer behoud van restnierfunctie zoals dit ook gezien wordt bij incrementele hemodialyse. Er zijn geen aanwijzingen voor een toename van complicaties bij patiënten die starten met incrementele PD. 2-4
Zie tabel 1 voor een handreiking met startschema’s voor de toepassing van incrementele PD.
Tabel 1. Praktische handreiking voor toepassing van incrementele peritoneale dialyse
Indien gekozen wordt te starten met incrementele peritoneale dialyse kan het voorschrift worden afgestemd op de wensen en medische situatie van de patiënt. Hieronder enkele voorbeelden die kunnen dienen als startpunt. Het volume van de wisseling kan worden aangepast aan het postuur van de patiënt.
|
|
CAPD |
APD |
|
Volledige standaard dosis |
|
|
|
Incrementele schema’s |
|
|
Dit hoofdstuk is gebaseerd op het corresponderende hoofdstuk uit de ISPD richtlijn: ‘Delivering peritoneal dialysis for the multimorbid, frail and palliative patient’ en aangepast aan de Nederlandse praktijk. 1
PD patiënten in Nederland worden steeds ouder, hebben meer comorbiditeit en zijn vaak kwetsbaar. 2,3Kwetsbaarheid gaat bij dialysepatiënten gepaard met een hoger risico op complicaties, sterfte en verminderde kwaliteit van leven. Er zijn verscheidene criteria opgesteld voor kwetsbaarheid, meestal betreft het een samengestelde maat van o.a. fysiek functioneren, voedingstoestand, cognitie en somatische morbiditeit. 4
De richtlijncommissie adviseert om bij PD patiënten boven de 70 jaar de mate van kwetsbaarheid in kaart te brengen rondom start van dialyse en daarna jaarlijks. Dit kan door middel van een nefrogeriatisch assessment (NGA). Dit overlapt grotendeels met de PROMs vragenlijsten en de subjective global assessment (SGA) zoals beschreven in hoofdstukken 2 en 5. Eventueel kan ook bij patiënten onder de 70 jaar een kwetsbaarheidsanalyse worden uitgevoerd indien er klinisch aanwijzingen zijn voor kwetsbaarheid. De resultaten van een NGA kunnen de basis vormen voor een multidisciplinair overleg door het behandelteam.
Op dit moment wordt het gebruik van een NGA bij oudere nierpatiënten geëvalueerd in de POLDER en DIALOGICA studies. Er kan overwogen worden het NGA uit deze zorgevaluatieprojecten te gebruiken als basis voor het assessment om zo te streven naar uniformiteit in de screeningsmethodiek. 5 Een goede samenwerking tussen het nefrologisch behandelteam en de klinisch geriater/internist-ouderengeneeskunde kan helpen bij de implementatie van een dergelijk assessment. Het maakt laagdrempelige en doelmatige verwijzing voor aanvullend onderzoek mogelijk, bijvoorbeeld naar cognitieve stoornissen of bij (dreigende) functionele achteruitgang. De klinisch geriater/internist-ouderengeneeskunde kan dan eventueel ook bijdragen aan het opstellen van een geïndividualiseerd behandelplan bij complexere geriatrische syndromen.
De behandeling van PD patiënten met multimorbiditeit is niet anders dan die van andere patiënten met meerdere aandoeningen. Hierbij ligt de nadruk op het exploreren van de ziekten en behandelingen die de grootste inbreuk maken op de kwaliteit van leven en de individuele voorkeuren van de patiënt. Tegelijkertijd dient door de hoofbehandelaar te worden gewaakt voor het optreden van ongewenste interacties tussen verschillende behandelingen door medisch professionals die zich elk focussen op één aandoening. Daarnaast dienen een hoge pill burden en het optreden van complicaties met noodzaak tot acute ongeplande zorg zoveel mogelijk te worden vermeden, temeer polyfarmacie bij dialysepatiënten geassocieerd is met een verminderde kwaliteit van leven. 6
Bij patiënten met een beperkte levensverwachting wordt het starten van nierfunctie vervangende behandeling doorgaans afgeraden. Patiënt en zijn behandelaren dienen zich af te vragen wat met dialyse gewonnen wordt, aangezien starten met nierfunctievervangende behandeling meestal niet zal bijdragen aan levensverlenging. Het kan worden overwogen ter behoud, of misschien verbetering, van kwaliteit van leven. Behandeling dient dan met name gericht te zijn op symptoomreductie, behoud van fysieke en cognitieve functies en deelname aan de maatschappij. Hierbij kan, met name bij patiënten met restnierfunctie, gekozen worden voor een aangepast PD schema, bijvoorbeeld met een dialysevrij dag(deel) of minder wisselingen per dag. In deze groep is niet bekend welke klaringsdoelen nagestreefd zouden moeten worden. Het dialysevoorschrift kan worden bijgesteld op geleide van uremische symptomen en worden afgewogen tegen de belasting van de therapie, en niet op basis van achteruitgang van restnierfunctie en/of afname van Kt/V. Dit is een verschil ten opzichte van incrementele dialyse. Er wordt derhalve geen aanbeveling gedaan aangaande de controlefrequentie van restnierfunctie en gecombineerde Kt/V meting bij deze kwetsbare patiëntengroep.
Tabel 2. Voorbeeld van een nefrogeriatrisch assessment 4
|
Domein |
Test |
Type |
|
Functionele status |
Katz ADL |
Vragenlijst |
|
|
iADL (Lawton) |
Vragenlijst |
|
|
Fall risk assessment |
Test |
|
|
Subjective global assessment (SGA) |
Test |
|
Psychische status |
Montreal cognitive assessment (MOCA) |
Test |
|
|
Geriatric depression scale (GDS) |
Vragenlijst door interviewer |
|
Somatische status |
Clinical frailty scale |
Vragenlijst voor behandelaar |
|
|
Charlson comorbidity index |
Vragenlijst voor behandelaar |
|
|
Surprise question |
Vragenlijst voor behandelaar |
|
Kwaliteit van leven |
Short Form 12 |
Vragenlijst |
|
|
Dialysis symptom index |
Vragenlijst |
© 2022. Alle rechten voorbehouden