Tolvaptan (Jinarc®) is door de European Medicines Agency (EMA) goedgekeurd voor behandeling van patienten met ADPKD. Naar aanleiding van de beoordeling door Zorginstituut Nederland (ZiN), wordt het gebruik van tolvaptan vanaf februari 2017 in Nederland vergoed.
De richtlijn geeft klinisch praktische aanbevelingen voor de selectie van patiënten, die in aanmerking komen voor behandeling met tolvaptan en voor het monitoren van patiënten die worden behandeld met tolvaptan.
Alle internist-nefrologen die patiënten met ADPKD behandelen.
Namens de richtlijncommissie verantwoordelijk voor de richtlijn:
drs.M J. Krol- van Straaten internist-nefroloog HAGA ziekenhuis
Deze tekst is opgesteld door Dr. D. Soonawala, internist-nefroloog HAGA ziekenhuis en LUMC en dr. E. Meijer, UMCG en aangepast en van commentaar voorzien door de richtlijncommissie van de NFN en door internist-nefrologen met expertise op het gebied van ADPKD, te weten:
Prof. dr. R.T. Gansevoort, UMCG, dr. F.W. Visser, ZGT, prof. dr. M.G. Vervloet, VUMC, prof. dr T. Nijenhuis, Radboudumc, prof. dr. E.J. Hoorn, dr. M. Salih, Erasmus MC.
De richtlijncommissie heeft de uitgangsvragen en onderwerpen overgenomen, zoals geformuleerd in de ‘position statement’, die is uitgebracht door de ERA-EDTA Working Groups of Inherited Kidney Disorders and European Renal Best Practice (ERBP). Na verschijnen van de update van het consensus statement in 2021, zijn deze aangepast.
De richtlijn is gebaseerd op:
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk toepasbaar is. Er kunnen zich feiten of omstandigheden voordoen waardoor, in het belang van goede zorg voor de patiënt, van een richtlijn dient te worden afgeweken.
Tolvaptan is een vasopressine 2 (V2) receptor antagonist. Uit de Tempo 3:4 trial (https://www.nejm.org/doi/full/10.1056/NEJMoa1205511) blijkt tolvaptan het verlies van nierfunctie door ADPKD te kunnen vertragen. Bij de studiepopulatie met een gemiddelde leeftijd van 39 jaar en een gemiddelde eGFR (CKD-EPI) van 81 ml/min/1.73m2 en een behandelduur van 3 jaar was de snelheid van de achteruitgang in de eGFR jaarlijks 26% minder in de behandelgroep dan in de placebo groep. https://www.nejm.org/doi/full/10.1056/NEJMoa1710030). Ook op langere termijn (Follow-up tot 11j, mediaan 4j) wordt een vergelijkbaar renoprotectief effect gezien van tolvaptan behandeling bij bijna 100 ADPKD patiënten in de Mayo Clinic in vergelijking met historische controles (Edwards ea, cJASN 2018). In de farmaco-economische analyses die voor het Zorg Instituut Nederland zijn uitgevoerd wordt werd ge-extrapoleerd dat 4 jaar behandeling 1 jaar uitstel van nierfunctievervangende therapie induceert. Een open-label extensie studie laat zien dat bij continuering van de behandeling het effect van tolvaptan op vermindering van de snelheid waarmee de eGFR daalt aanblijft na de eerste 3 jaar therapie.
Inherent aan het werkingsmechanisme is een reductie van het concentrerend vermogen van de nieren waardoor aquarese ontstaat met polyurie en dorst als gevolg. Bij de start van de behandeling is er een daling van de GFR, analoog aan hetgeen er gebeurt bij het starten van bijvoorbeeld een ACE-inhibitor. In de Tempo 3:4 trial stopte 23% voortijdig het gebruik van tolvaptan, circa 8% i.v.m. aquarese gerelateerde klachten (polyurie en polydipsie) en 15% i.v.m. andere redenen, veelal van logistieke aard. In de placebo groep was dit 13.8%. Daarnaast kan, met name in de eerste 18 maanden na start van de medicatie, een verhoging van de transaminasen optreden. In de tolvaptan groep gebeurde dit in 4.9% en in de placebo groep in 1.2% van de patiënten. Een zeer klein aantal patiënten ontwikkelde op tolvaptan naast een stijging in transaminase ook een stijging in serum bilirubine (N=2), hetgeen kan duiden op ernstige hepatoxiciteit. Na staken van medicatie waren deze afwijkingen reversibel. Wel is dit reden dat er gedurende de eerste 18 maanden van gebruik leverenzymen gecontroleerd moeten worden. De bijsluiter van tolvaptan bevat specifieke adviezen wanneer medicatie (tijdelijk) gestaakt dient te worden in geval van afwijkende leverenzymwaarden.
De European Medicines Agency heeft tolvaptan goedgekeurd voor “adult ADPKD patients with CKD stages 1/3 and evidence of rapidly progressive disease”. De ERA working group on inherited kidney disorders (WGiKD) heeft samen met de European Rare Kidney disorders Network (ERKNet) en PKD international in 2021 een geüpdate ‘consensus statement’ opgesteld waarin deze indicatie wordt geoperationaliseerd en waarin wordt aangegeven welke patiënten met ADPKD het meest gebaat kunnen zijn bij een behandeling met tolvaptan. De richtlijncommissie heeft de uitgangspunten en aanbevelingen van dit document overgenomen.
https://academic.oup.com/ndt/advance-article/doi/10.1093/ndt/gfab312/6431643?login=true
(bijlage 1)
|
Aanbeveling 1: Het selecteren van patiënten voor behandeling met tolvaptan dient plaats te vinden in lijn met de ‘consensus statement’ van de ERA. Hiervan kan in selecte gevallen worden afgeweken. |
De richtlijnencommissie onderschrijft de aanbeveling van de ERA om behandeling met tolvaptan te overwegen bij patiënten met ADPKD in de leeftijd van 18-55 jaar, bij wie de ziekte tekenen van snelle progressie vertoont. Het consensus document geeft aan dat behandeling mogelijk is bij een eGFR>25. Echter in Nederland wordt behandeling vergoed voor mensen met CKD stadium 1 tot 3b, oftewel een eGFR >30 ml/min (naar aanleiding van resultaten van de Reprise studie) en snelle ziekte progressie. Bij de lagere nierfuncties kan de gezondheidswinst beperkt zijn, gezien er niet veel jaren meer resteren tot het bereiken van eindstadium nierfalen. De criteria voor behandeling zijn ruimer dan in het vorige consensus statement, het is daarom belangrijk goed te bepalen of er daadwerkelijk (hoog risico op) snelle ziekte progressie is (met name bij de betere nierfunctie moeilijk). Het is aan te raden om bij deze categorieën, bij een eGFR aan de ondergrens en bij twijfel over de indicatie te overleggen met een expertisecentrum.
Het is aan de behandelaar om te bepalen welke maat voor GFR bij een individuele patiënt het beste de daadwerkelijke GFR benadert (geschatte GFR, d.w.z. eGFR, of berekende kreatinine klaring, d.w.z. endogene kreatinine klaring). (In het geval dat de patiënt qua spiermassa sterk afwijkt van het gemiddelde, dient niet blind te worden gevaren op de uitslag van de CKD-EPI formule.)
De diagnose ADPKD dient gesteld te zijn volgens de gangbare criteria (bijlage 2). Behandeling is geindiceerd bij patienten met gedocumenteerde snelle verslechtering van de nierfunctie, of gedocumenteerde toename in de volume van de nieren. In geval historische data wat betreft nierfunctie dan wel niervolume beloop ontbreken, of onvoldoende betrouwbaar zijn (bijv. in het geval van CKD stadium 1), kan met risicovoorspellers worden gewerkt (tabel 2), door gebruik te maken van bijvoorbeeld de Pro-PKD score (Tabel 3). Voor het bepalen van deze score is genetisch onderzoek noodzakelijk.
Algoritme om patiënten te selecteren die voor behandeling in aanmerking komen
Er is op theoretische gronden gesuggereerd dat tolvaptan hyperglykemie kan veroorzaken . In de Tempo 3:4 trial werd dit niet waargenomen (hyperglykemie tolvaptan groep 0.6%, placebo 2.1%), maar patiënten met slecht geregelde diabetes mellitus waren uitgesloten van deelname. Bij patiënten met diabetes wordt daarom toch extra oplettendheid geadviseerd
N.B. het gebruik van een diureticum in combinatie met tolvaptan werd in de TEMPO 3:4 studie protocollair ontraden in verband met de theoretische kans op elektrolytstoornissen. Deze combinatie van geneesmiddelen dient daarom vooralsnog vermeden te worden totdat meer ervaring is opgedaan of deze combinatie veilig is.
Figure 1: ERA WGIKD/ERKNeT Position statement 2021
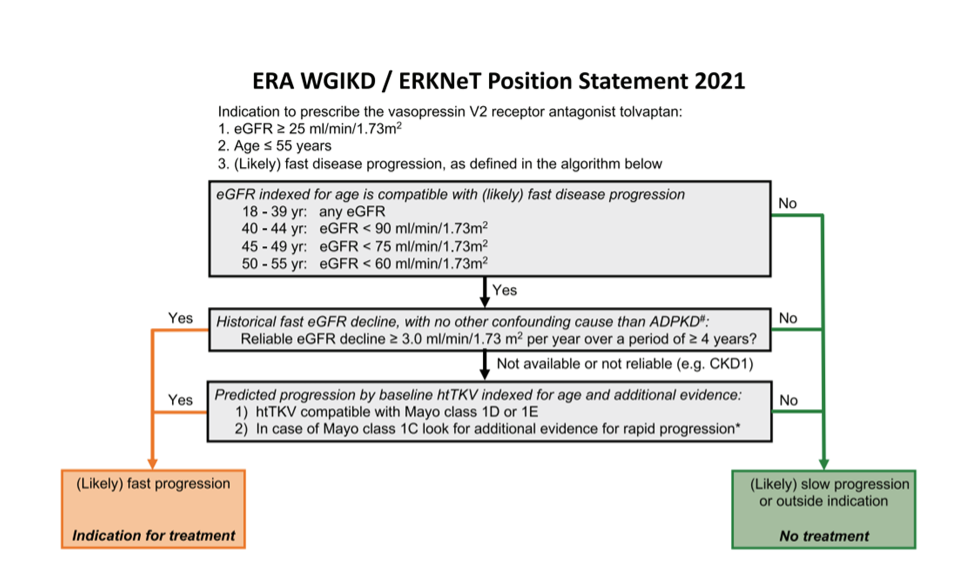
Algoritme van de ERA WGIKD/EKNet voor behandeling met een vasopressine V2 receptor antagonist (Muller ea, NDT 2021). De RLC neemt dit schema over met aanpassing van in principe een eGFR>30, gezien de vergoedingscriteria, zie de tekst op p5 en tabel op de volgende pagina.
Tabel 1. Het selecteren van patiënten die in aanmerking komen voor behandeling met tolvaptan.
|
1. |
Datum: Leeftijd: GFR: Patiënt voldoet aan de criteria voor GFR: 18-39 jaar GFR > 30 ml/min/1.73m2 40-44 jaar: GFR30-90 ml/min/1.73m2 45-49 jaar GFR 30-75 ml/min/1.73m2 50-55 jaar GFR 30-60 ml/min/1.73m2 |
JA (ga naar 2) NEE => komt niet in aanmerking tenzij gemotiveerd en na overleg met één van de expertisecentra genoemd in hoofdstuk 7 van deze richtlijn (ga naar 7) |
|
2. |
De historische GFR toont snelle progressie waarvan alleen ADPKD1 de oorzaak is: Betrouwbare GFR afname ≥ 3 ml/min/1.73m2 per jaar gedurende 4 jaar |
JA => overweeg behandeling NEE (geen behandeling) NIET BEKEND, OF GEGEVENS ONBETROUWBAAR, ZOALS BIJ CKD STADIUM 1 (ga naar 3) |
|
3. |
Patiënt valt volgens de Mayo classificatie, die berust op de leeftijd en op de met MRI gemeten height-adjusted TKV, in klasse 1D of 1E.2 Indien patient Mayo klasse 1C heeft, moeten er additionele aanwijzingen zijn voor snelle ziekte-progressie3 |
JA => overweeg behandeling NEE (geen behandeling) NIET BEKEND (ga naar 4) |
|
4. |
Andere reden om te starten met behandeling, namelijk:
Overlegd met:
|
JA NEE |
Indien bij vraag 2, of 3 ‘JA’ wordt ingevuld, voldoet de patiënt aan de criteria voor behandeling met tolvaptan, zoals geformuleerd door de ERA consensus statement en overgenomen door de richtlijnen commissie van de NFN.
GFR wordt in principe gemeten volgens de CKD-EPI formule (eGFR). Hiervan kan worden afgeweken.
1Als alternatieve verklaringen voor de nierfunctie-achteruitgang waarschijnlijk zijn, dan moet er terughoudendheid zijn tolvaptan te starten ondanks de nierfunctie-achteruitgang. Redenen om aan alternatieve verklaring van de nierfunctie-achteruitgang te denken zijn proteinurie >1g/24u, tekenen van vasculair lijden (coronair lijden, CVA), ongecontroleerde ernstige hypertensie en diabetes mellitus. In deze gevallen wordt aangeraden additionele informatie (inclusief MRI/CT) te verkrijgen om vast te stellen dat ADPKD de primaire reden is voor de nierfunctie-achteruitgang.
2Voor deze meting kan de ellipsoide formule worden gebruikt, die valide is voor patiënten met een typisch ADPKD beeld. Zie:https://www.mayo.edu/research/documents/pkd-center-adpkd-classification/doc-20094754. In de praktijk zal veelal geen CT of MRI voorhanden zijn en zal het echografie-criterium (vraag 5) worden gebruikt om patiënten te selecteren die voor behandeling in aanmerking komen. In geval echografie geen uitsluitsel geeft, zoals bij iemand met veel levercysten bij wie de bovengrens van de nier(en) niet goed is af te grenzen, is het aan te raden een MRI of CT te verrichten).
3Mayo klasse 1C is erg gemengd wat betreft ziekte-progressie. Er moeten daarom additionele aanwijzingen voor ziekte-progressie zijn (Tabel 2). Hieronder vallen een ProPKD score >6 (Tabel 3), vroege hypertensie/urologische manifestaties, truncating PKD1 mutatie, en positieve familie anamnese (start van dialyse <60j bij tenminste 2 eerstelijns familieleden.
Tabel 2. Belangrijkste parameters om snelle ziekte progressie vast te stellen
|
Parameter |
Vaststellen van snelle ziekteprogressie |
|
eGFR aangepast voor de leeftijd |
Is de GFR onverwacht laag voor de leeftijd van patient? |
|
Niervolume/Mayo klasse |
Klasse 1D en 1E: snelle ziekte progressie Klasse 1C: individuele assessment |
|
Nierlengte (op echo) |
>16,5cm op ≤46 jaar |
|
ProPKD score |
>6 |
|
Genetica |
Truncerende PKD1 mutatie |
|
Vroege start van urologische symptomen |
Macroscopische hematurie, cystebloeding, flankpijn of cyste infectie <35 jaar |
|
Vroege start van hypertensie |
Hypertensie <35 jaar |
|
Familie anamnese |
Bereikten de meeste familieleden eindstadium nierfalen <58 jaar? |
Tabel 3. Pro-PKD score*
|
Man |
1 punt |
|
Hoge bloeddruk voor het 35e levensjaar |
2 punten |
|
Eerste urologisch voorgeval voor het 35elevensjaar (macroscopische hematurie, flankpijn, cyste-infectie). |
2 punten |
|
Niet-truncerende PKD1 mutatie |
2 punten |
|
Truncerende PKD1 mutatie |
4 punten |
|
PKD2 mutatie |
0 punten |
*De Pro-PKD score kan niet worden gebruikt voor voorspelling van snelle progressie bij mensen jonger dan 35 jaar.
De RLC volgt de overweging en aanbeveling van de ERA:
“The dose of tolvaptan should be prescribed as used in the clinical trial that demonstrated treatment efficacy, i.e. starting tolvaptan at 45 mg in the morning and 15 mg in the after- noon, to be uptitrated, when tolerated, to 60/30 and 90/30 mg, respectively. In the TEMPO 3:4 trial, 23% of patients withdrew from therapy during the 3 years of the trial. The remaining patients used an average total daily dose of 95 mg tolvaptan. Of the patients who completed the trial, 55% took the high dose (a total daily dose of 120 mg), whereas 21 and 24% took the middle dose (90 mg) and low dose (60 mg), respectively”.
|
Aanbeveling 2: Tolvaptan dient gestart te worden in een dosering van 45 mg in de ochtend en 15 mg aan het einde van de middag (8 uur na de ochtenddosering).
Aanbeveling 3: De dosering moet worden verhoogd naar 60/30 en tot 90/30 mg, indien dit wordt verdragen.
Aanbeveling 4: Tolvaptan dient gestaakt te worden indien patienten CKD stadium 5 bereiken, gelet op de verwachting dat het geen gunstig effect heeft in dit stadium en mogelijk zelfs een nadelig effect en gelet op afweging van de kosten versus de baten.
|
In de TEMPO 3:4 studie werd tolvaptan per week opgetitreerd. In de klinische praktijk stimuleert de verpakking van tolvaptan maandelijks optitreren. Het is belangrijjk om de dosering te verhogen, conform aanbeveling 3. Het grootste effect op diurese ontstaat bij het starten van de behandeling met de 45+15 mg dosering en niet bij het ophogen van de dosering.
Elke 28 dagen dient een nieuw recept te worden uitgeschreven. Na 18 maanden kan voor langere tijd worden voorgeschreven. Alle apotheken in Nederland kunnen tolvaptan (generiek) bestellen.
Tolvaptan wordt gemetaboliseerd door CYP3A. Gelijktijdig gebruik van geneesmiddelen die CYP3A-remmen leidt tot verhoogde plasmaconcentraties voor tolvaptan. Gebruik van CYP3A-inductoren leidt tot verlaagde plasmaconcentraties voor tolvaptan (zie bijlage 4).
De prijs van tolvaptan is onafhankelijk van de dosering en bedraagt aldus het Farmacotherapeutisch Kompas voor zowel Jinarc® als generiek tolvaptan.
|
Kosten per pakket 28 dagen |
€1.515,10 |
Aanbeveling 5: Counseling van patiënten over de werking van tolvaptan en over de impact op het dagelijkse leven is essentieel voor een succesvolle behandeling.
Algemene overwegingen:
Aquaretische bijwerkingen in onderzoeken:
Praktische aanbevelingen om de polyurie en/of nycturie te beperken en beter te verdragen:
Referenties:
Elke Internist-nefroloog, die zich bekwaam acht, mag tolvaptan voor te schrijven aan patiënten met ADPKD. Gelet op de vereiste expertise wat betreft beoordelen van indicatie, het counselen van patiënten, het begeleiden van patiënten tijdens gebruik en de tijd die dit kost, raadt de RLC aan om de start van de behandeling in een ziekenhuis of regio te concentreren bij enkele personen. Indien het selecteren van patiënten voor behandeling en/of het starten van een behandeling niet past binnen de logistiek van een ziekenhuis, kan worden verwezen naar een centrum, waar extra aandacht is voor patiënten met ADPKD en waar ervaring is met het gebruik van tolvaptan. Op dit moment bieden de volgende centra deze service:
Voor het motiveren van patiënten om de therapie dagelijks conform voorschrift te gebruiken is veel aandacht en advies nodig betreffende praktische zaken zoals adviezen rondom werk, sport, uitgaan, reizen en ziekte, wanneer en hoe (tijdelijk) medicatie te stoppen. De behandelaar dient zich ervan bewust te zijn dat het een complexe behandeling betreft.
Idiosyncratische levertoxiciteit is opgetreden, met name in de eerste 18 maanden van de behandeling. Leverenzymen (ALAT en bilirubine) en elektrolyten (ureum, Na) dienen daarom maandelijks te worden gecontroleerd gedurende de eerste 18 maanden. Indien er geen toxiciteit is kan voor de volgende 28 dagen worden voorgeschreven. Na 18 maanden kan voor een langere periode worden voorgeschreven, maximaal drie.
Naast de leverenzymen en elektrolyten moet minimaal 1 maal per 3 maanden controle plaatsvinden van bloeddruk, diurese, nierfunctie, urinezuur en glucose.
Tolvaptan moet gestaakt worden indien:
In geval van hypotensie / sepsis / gastro-enteritis moet het middel tijdelijk gestopt worden. Nadien kan het middel in de voor patiënt gebruikelijke dosering herstart worden.
In geval de nierfunctie CKD stadium 5 nadert, dient tolvaptan gestaakt te worden.
© 2022. Alle rechten voorbehouden
Richtlijncommissie van de Nederlandse Federatie voor Nefrologie
De richtlijn wordt na 2 jaar herzien. Indien er voor die termijn nieuwe wetenschappelijke ontwikkelingen zijn die herziening noodzakelijk maken, zal de richtlijncommissie dat eerder laten plaatsvinden.